Aquesta tècnica troba aplicació en volumetries àcid-base, atesa la dependència del potencial d’un elèctrode, com el d’hidrogen, emprat comunament com a referència, amb la concentració dels seus ions en el si de la dissolució a valorar, i el punt final es caracteritza per una sobtada variació del potencial en afegir una petita quantitat del reactiu valorant; també troba aplicació en les volumetries de precipitació, amb un fonament anàleg al de les àcid-base, i és de gran valor per a la determinació d’halogenurs i de cianur amb l’ió argent, Ag +
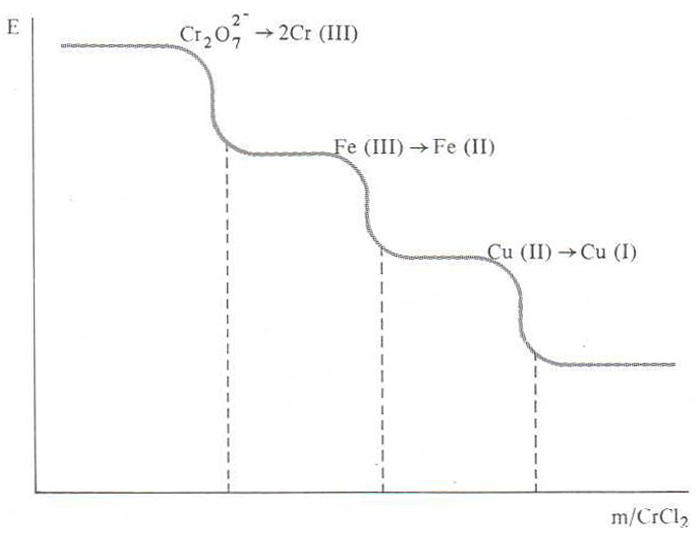
. Amb tot, l’aplicació fonamental del mètode potenciomètric està en les volumetries d’oxidoreducció, per a les quals hom sol emprar un elèctrode de reixa de platí platinat i amb les quals hom pot determinar alhora les concentracions de diverses espècies oxidables o reduïbles amb la condició que tinguin potencials d’oxidoreducció (potencial d’elèctrode) prou diferenciats. Igualment, el punt final de la valoració de cada espècie es manifesta en una variació brusca del potencial. En el cas general de la valoració amb un únic reductor d’una mescla de diversos oxidants, les successives transicions observades segueixen una gradació que va de l’oxidant més fort al més feble. Per a la realització pràctica de les potenciometries, hom introdueix l’elèctrode adequat en la dissolució a valorar i, mitjançant un pont salí, estableix un contacte electrolític amb un elèctrode patró, usualment el de calomelans. La pila així formada és connectada a un potenciòmetre, el qual enregistrarà les variacions de potencial al llarg de l’addició del reactiu valorant, degudes únicament a la semipila problema.
f
Química