Si la reacció bé representada per l’equació
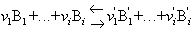
i les substàncies reaccionants B1,...,Bi,B'1,...,B'i tenen a l’equilibri les activitats a1,...,ai,a'1,...,a'i, la llei d’acció s’expressa matemàticament per la relació
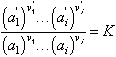
on K, anomenada constant d’equilibri, és invariable a temperatura constant. Quan es tracta de gasos a pressions moderades, que poden ésser assimilats a gasos perfectes, o de solucions diluïdes que obeeixen les lleis dels gasos perfectes, les activitats poden ésser substituïdes, amb aproximació suficient, per les fraccions molars, i aquestes a llur torn poden ésser substituïdes, en el cas dels gasos per les pressions parcials, i en el cas de les solucions per les concentracions molars. Els valors numèrics de la constant K queden en general modificats en virtut d’aquestes darreres substitucions (llevat que el nombre total de molècules no variï), però K continua depenent només de la temperatura. D’altra banda, si una de les substàncies reaccionants és un sòlid pur, la seva activitat és constant a temperatura constant, i, per tant, el seu valor pot ésser integrat a la constant d’equilibri, de forma que, en l’expressió de la llei, hom pot limitar-se a les substàncies presents únicament en la fase gasosa o en solució. La llei d’acció de massa, expressada en funció de les concentracions, fou deduïda de consideracions cinètiques per Guldberg i Waage l’any 1864, que admeteren que la velocitat d’una reacció és proporcional a les concentracions de les substàncies reaccionants. No obstant això, la noció d'acció de massa, és a dir, de la influència de la concentració d’una substància sobre la seva tendència a reaccionar, havia ja estat explícitament enunciada molt abans per Berthollet (1799). Una demostració rigorosa de la llei, amb independència de tota hipòtesi sobre les velocitats de reacció, pot ésser obtinguda mitjançant la termodinàmica. La llei d’acció de massa és una de les més importants de la química i les seves aplicacions són molt nombroses. En particular, la llei permet de deduir d’una manera immediata, no solament els desplaçaments d’equilibri que resulten de la introducció o eliminació d’una de les substàncies reaccionants, sinó també els que són produïts en fase gasosa, en virtut de les variacions de pressió. En el cas dels sistemes heterogenis, la llei forneix l’explicació dels fenòmens observats en la dissociació tèrmica, és a dir, en la descomposició d’un sòlid amb formació de gas.