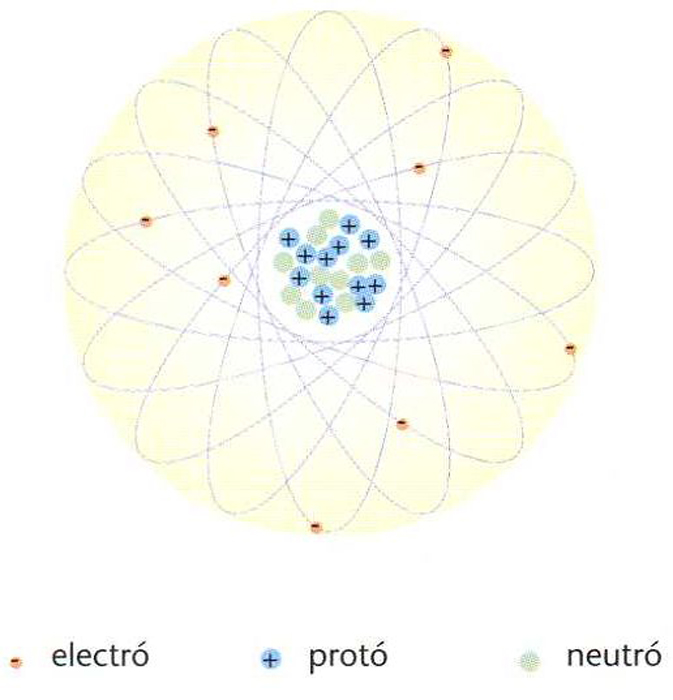
Bàsicament un àtom consta de dues parts. D’una banda el nucli, format per protons i neutrons, que conté gairebé tota la massa de l’àtom (~99,9%) però que només n’ocupa una part infíma (~10-5 vegades les seves dimensions). Els electrons, d’altra banda, envolten el nucli formant capes a diferents nivells i, a conseqüència de llur càrrega elèctrica negativa, neutralitzen la càrrega positiva del nucli. Les masses dels àtoms van dels 10-27 kg als 10-25 kg, i llurs dimensions dels 10-10 m als 10-9 m.
Els àtoms d’un mateix element tenen el mateix nombre de protons i electrons (nombre atòmic, Z), la qual cosa determina les propietats químiques de l’element. Tanmateix, àtoms d’un mateix element poden tenir diferent nombre de neutrons (nombre neutrònic, N) al nucli. Per tal de distingir aquests diferents isòtop d’un element, cal especificar el nombre de massa, A = Z + N, que dóna el nombre total de nucleons (protons i neutrons) del nucli. Aquest nombre de massa A multiplicat per la massa d’un protó dóna, aproximadament, el pes de l’àtom (expressat en unitats de massa atòmica) o pes atòmic (també anomenat massa atòmica).
Els diferents isòtops d’un element tenen propietats físiques diferents. Una classificació dels element d’acord amb el nombre atòmic (taula periòdica) evidencia una periodicitat de propietats. Els àtoms rarament es troben lliures, independents, sinó que tendeixen a agrupar-se formant molècules, de les quals és formada tota la matèria. L’estudi dels àtoms és, doncs, d’una importància cabdal. A aquest efecte, cal conèixer quins són els components que els constitueixen i com s’agrupen per formar l’estructura de l’àtom. Quant a aquesta, és conseqüència de dues interaccions: la interacció forta, que manté units els nucleons, i la interacció electromagnètica, que controla la interacció entre les partícules carregades elèctricament, electrons i protons.
Tant en els àtoms amb elevat nombre atòmic, com en l’àtom més senzill, el d’hidrogen, una descripció teòrica, en termes d’un model predictiu fisicomatemàtic, que hom pugui contrastar amb les observacions experimentals, requereix la intervenció de complexes idees de la física matemàtica. Al llarg del segle XX hom ha constatat la impossibilitat de fornir un model mecànic de l’àtom a la manera típica del segle XIX. Han estat descobriments inesperats (com el de la radioactivitat) o l’elaboració de teories innovadores (com la mecànica quàntica), els fets que han permès millorar el coneixement sobre el microcosmos (física al nivell atòmic i subatòmic) alhora que han representat el naixement de noves tecnologies (com l’energia nuclear).
Evolució del concepte d’àtom
El camí que ha menat al model actual de l’àtom (sovint representat incorrectament com un petit sistema solar, els electrons orbitant al nucli) ha estat llarg i enrevessat. Dificultat característica d’aquest procés ha estat la inobservabilitat directa dels àtoms, que ha obligat a haver-ne de deduir l’existència indirectament. Probablement la primera concepció atòmica fou formulada a l’Índia al segle VII aC pels seguidors de la secta Ajīvika, per als quals els àtoms elementals eren cinc: el vital i els quatre àtoms formadors (terra, aire, foc i aigua) que combinats constituïen totes les coses, animades o inanimades.
A Grècia, cap al 450 aC Leucip de Milet establí la teoria que la matèria no era divisible indefinidament, sinó que era constituïda per petites unitats materials, els àtoms (del grec ‘áτομος, indivisible). El seu deixeble, Demòcrit d’Abdera (420 aC) descriví la matèria com una aglomeració en el buit d’àtoms invisibles, indivisibles i eterns. Epicur (341-270 aC) reprengué les concepcions de Demòcrit, tot atribuint a l’àtom les raons de les combinacions. Segons Kanāda (~250 aC), fundador del sistema filosòfic hindú Vaiśeshika, l’àtom (aṇu) era un punt de l’espai, sense llargada, amplada o gruix; quatre paramāṇus (àtoms extrems), de terra, d’aigua, de foc i d’aire, eren els components essencials de totes les coses materials.
A Roma, el poeta i filòsof Lucreci (94-54 aC) continuà la tradició atomística grega en la seva obra De Rerum Natura. A l’edat mitjana es produí un retrocés respecte de l’atomisme, en imposar-se l’alquímia com a estudi qualitatiu de la matèria. Oblidant-se de la noció d’àtom, es consolidà la teoria segons la qual el buit no existeix, defensant que la matèria és infinitament divisible i que tots els cossos són formats de només quatre elements (foc, terra, aire i aigua), presos en diferents proporcions, que serien el suport de les quatre propietats fonamentals (la calor, el fred, la sequedat i la humitat). Com a aspecte positiu, val a dir que l’alquímia intuí la transmutació de la matèria i recercà la conversió dels metalls en or a còpia de canviar les proporcions dels quatre elements fonamentals amb l’ajut d’un catalizador, la pedra filosofal.
Pierre Gassendi (1592-1655), ja més ençà, acceptà l’existència del buit i suposà que les molècules d’aire són separades. Robert Boyle (1627-55), en estudiar la compressibilitat dels gasos, arribà a la conclusió que han d’ésser constituïts per corpuscles que es desplacen en el buit. El treball dels químics del final del segle XVIII i començament del segle XIX, pioners de l’estudi quantitatiu de les reaccions químiques, suposà l’afirmació gradual de la idea que la matèria és formada per àtoms i que són els processos submicroscòpics els que regeixen el comportament de la matèria ordinària. En aquest procés deductiu fou d’especial importància el descobriment de les lleis fonamentals de la combinació química.
El 1774 Lavoisier demostrà que en les reaccions químiques ordinàries la massa total roman constant (llei de conservació de la massa). El 1799, J.L. Proust establí la llei de les proporcions definides (quan dos o més elements es combinen per formar un compost ho fan sempre amb una relació de pesos definida i constant), que fou àmpliament corroborada més tard per Berzelius. El 1804, J. Dalton enuncià la llei de les proporcions múltiples (quan dos elements es combinen per formar més d’un compost, els pesos d’un dels elements que es combinen amb un mateix pes de l’altre són en relació de nombres enters petits). Dalton introduí també les beceroles de la teoria atòmica moderna, quan el 1805 enuncià que totes les substàncies podien considerar-se formades per àtoms, partícules invisibles i indestructibles. Els àtoms d’un mateix element eren idèntics i un compost químic resultava de la combinació àtom-àtom dels reaccionants per formar una molècula del compost. La teoria de Dalton era capaç d’explicar les lleis de Lavoisier, Proust i la de les proporcions múltiples.
Del 1805 al 1809, J.L. Gay-Lussac, en estudiar reaccions entre gasos, enuncià la llei dels volums de combinació (els volums de gasos que reaccionen entre si, o bé els dels reaccionants i els dels productes, són en la relació de nombres enters petits). El 1811 A. Avogadro, basant-se en els coneixements sobre les reaccions dels gasos, enuncià la seva llei, segons la qual volums iguals de qualsevol gas, mesurats a la mateixa pressió i temperatura, contenen el mateix nombre d’àtoms o molècules. La llei d’Avogadro proporcionà una manera de mesurar els pesos relatius dels àtoms dels diferents elements, amb la qual cosa hom disposà per primer cop d’una imatge quantitativa dels àtoms, dels quals podien començar a sorgir models.
Així, W. Prout, metge anglès, proposà el 1815 que els àtoms eren aglomerats d’àtoms d’hidrogen (que ell anomena protil), idea que li fou suggerida pel fet que els pesos atòmics d’alguns elements, prenent-los en relació amb el pes atòmic de l’hidrogen, eren valors pràcticament enters. Aquesta hipòtesi hagué d’ésser rebutjada en mesurar pesos atòmics no enters per a alguns elements (clor 35,5; coure 63,6). A partir de les seves experiències d’electròlisi, Faraday deduí el 1834 que cada àtom havia de posseir una mateixa quantitat d’electricitat, primer indici aquest del descobriment de l’electró com a component dels àtoms. El 1874, l’irlandès Stoney suposà que en l’electròlisi cada àtom transportava la mateixa càrrega elèctrica, de manera que, dividint la quantitat d’electricitat necessària per dissociar un àtom gram pel nombre d’Avogadro, hom obtenia el valor d’una unitat natural d’electricitat que, el 1891, ell mateix anomenà electró, tot i que corresponia a una noció ben diferent de l’actual.
El 1858 J. Plücker descobrí els raigs catòdics, que J. Hittorf estudià detingudament. D’ençà del 1876, E. Goldstein mostrà que aquests raigs eren deflectits per camps magnètics. J.P. Perrin mostrà el 1895 que transportaven càrrega elèctrica negativa i suggerí que podia tractar-se d’un feix de partícules carregades. Mitjançant un camp elèctric, que podia alentir el feix, determinà la relació càrrega/massa d’aquestes hipotètiques partícules. Aquesta relació, posteriorment millorada per J.J. Thomson (1897), apuntà l’existència d’una partícula elemental de càrrega elèctrica negativa, que hom anomenà electró. D’altra banda, les observacions que d’ençà del 1886 féu Goldstein sobre els raigs canals, i les experiències amb camps magnètics que en féu W. Wien el 1898, indicaren l’existència d’una càrrega elemental positiva, amb càrrega igual a la de l’electró però amb signe oposat. Es tractava del protó.
El model atòmic de Bohr-Rutherford
Al principi del segle XX hom coneixia, doncs, l’existència de dues partícules de càrregues oposades, electró i protó, que podien explicar la neutralitat elèctrica dels àtoms. Calia esbrinar com els formaven, però. Perrin proposà el 1901 que l’àtom era com un petit sistema solar, els electrons orbitant una partícula central positiva. H. Nagaoka, tot seguint una idea similar, indicà el 1904 que tots els electrons es disposaven en òrbites a la mateixa distància del centre, movent-se amb la mateixa velocitat angular. J.J. Thomson (1903) descrigué l’àtom com una esfera carregada positivament sobre la qual s’aplegaven els electrons, oscil.lant a l’entorn del centre i neutralitzant-ne la càrrega. El descobriment de la radioactivitat per Becquerel (1896) estimulà les investigacions en una direcció que hom no havia mai considerat. Les emissions radioactives naturals de l’urani fornien partícules que hom podien usar com a projectils per a bombardejar àtoms.
Entre el 1908 i el 1909, H. Geiger, E. Marsden i E. Rutherford feren experiències de bombardeig d’una pel.lícula d’or amb partícules α i observaren que algunes eren desviades (posant en qüestió el model d’esfera neutra de Thomson) i que, fins i tot, algunes sortien rebotades. Com a conseqüència d’aquestes experiències, el 1911 Rutherford conclogué que l’àtom consistia d’una part central molt petita, que condensava la càrrega positiva (nucli), i d’un conjunt d’electrons que es movien d’alguna manera a gran distància, deixant un gran buit enmig. El model de Rutherford era qualitativament molt suggestiu, però estava en desacord amb les concepcions de la mecànica clàssica i de l’electromagnetisme. Una de les dificultats principals consistia a explicar com un electró en òrbita el.líptica al voltant del nucli (moviment que havia de seguir segons la mecànica clàssica) podia mantenir-se en òrbita estable si, d’acord amb l’electrodinàmica clàssica, havia d’emetre radiació a conseqüència del moviment accelerat i, per tant, perdre contínuament energia i decaure ràpidament (en un temps inferior als 10-10s) cap al nucli. Contra aquest requeriment de les teories clàssiques s’imposava l’evidència que els àtoms eren estables (no dequeien) i que la radiació emesa pels àtoms excitats no presentava un espectre continu, sinó que hi havia ratlles de freqüències ben determinades.
La solució del problema fou obra de N. Bohr, que el 1913, en fer una síntesi dels treballs de Planck i Rutherford, proposà un model que, violant l’electrodinàmica clàssica, conservava, però, el model mecànic clàssic. Segons Bohr, els electrons descrivien òrbites circulars, però només aquelles en què el moment angular era un múltiple enter posititu de h = h/2π, essent h la constant de Planck. No totes les òrbites eren possibles, sinó només les permeses per l’anterior condició: les òrbites eren quantitzades. Quan un electró passava d’una de les òrbites permeses Ei a una altra Ej, s’emetia radiació de freqüència v = [Ei - Ej] / h. La varietat de salts possibles explicava les diferents ratlles de la part visible de l’espectre d’emissió de l’hidrogen i permetia d’obtenir teòricament un valor de la constant de Rydberg que s’adeia amb l’obtingut experimentalment. Les mancances del model consistien en el fet que no explicava la intensitat de les ratlles espectrals, que no donava una bona explicació dels espectres d’àtoms de més d’un electró i que tampoc no podia explicar els detalls fins de l’espectre de l’hidrogen (estructura fina).
Posteriors millores del model, com la feta el 1915 per Sommerfeld, Wilson i Ishiwara o la incorporació d’aproximacions relativistes feta per Sommerfeld el 1919, aconseguiren de millorar algun resultat (explicació de l’estructura fina de l’hidrogen) però no acabaren de reeixir. Les causes de la incompletesa d’aquests models cal cercar-les en les seves bases, que no eren més que fràgils analogies amb models clàssics, i en la insostenibilitat d’algunes de les seves hipòtesis, com l’estabilitat no radiativa d’un electró en òrbita clàssica. La solució d’aquestes incoherències vingué amb el naixement de la mecànica quàntica, obra de De Broglie, Heisenberg, Schrödinger i Born. A més d’aquest nou marc teòric, que millorà el coneixement de l’estructura electrònica dels àtoms, el coneixement del nucli avançà molt gràcies als descobriments relacionats amb la radioactivitat.
L’àtom d’hidrogen segons la mecànica quàntica
La mecànica quàntica forneix un model força acurat de l’àtom més senzill, l’àtom d’hidrogen, que és format només per un protó i un electró. Fou resultat d’un canvi conceptual profund, en què les nocions bàsiques de la mecànica clàssica (els conceptes de variable dinàmica, estat, trajectòria i l’equació dinàmica) foren substituïdes per d’altres, la fonamentació de les quals no fou immediata ans gradual. Segons la mecànica quàntica, la informació que hom pot arribar a tenir sobre el moviment d’una partícula és limitada; hom no pot conèixer amb precisió el valor de totes les seves variables dinàmiques. Conseqüència d’aquesta limitació és la impossibilitat d’utilitzar el concepte clàssic de trajectòria per a la descripció del moviment d’una partícula del microcosmos. La funció d’ona, ψ(t, x), el mòdul de la qual s’interpreta com la probabilitat de trobar la partícula en un punt x de l’espai en un cert instant t, és el concepte que ha de substituir el de trajectòria. Les òrbites dels electrons del model de Bohr han d’ésser reemplaçades per núvols de probabilitat que assenyalin on hom pot trobar un electró i on no és mai possible. Aquestes zones a l’entorn del nucli tenen una forma matemàtica determinada, que hom obté com a solucions d’una equació dinàmica (equació de Schrödinger), i es caracteritzen pel valor de les variables dinàmiques dels electrons que les ocupen. En estudiar l’equació d’Schrödinger de l’àtom d’hidrogen, per al qual V (r)= -e2 / r, resulta que l’energia de l’electró només pot tenir un dels següents valors:
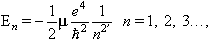
essent μ la massa de l’electró, e la seva càrrega i h la constant de Planck reduïda, h = h/2π. Al valor n = 1 correspon l’energia més petita; és l’estat fonamental, E₁. Conforme n creix l’energia del nivell creix; són els estats excitats, En. En saltar un electró del nivell En a un nivell inferior Em, s’emet energia
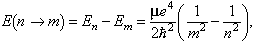
en forma de radiació de freqüència
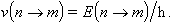
Fou un gran èxit de la mecànica quàntica el fet que les freqüències dels diferents salts possibles entre els nivells permesos coincidissin amb les freqüències de les ratlles d’emissió de l’espectre de l’àtom d’hidrogen. La solució completa de l’equació d’Schrödinger per a l’àtom d’hidrogen indica que l’estat d’un electró queda especificat pel valor de tres nombre quàntic. Un d’ells indica el nivell d’energia, n. El mòdul del moment angular, especificat pel nombre quàntic l, i una de les seves components, ml, completen el coneixement que a hom li és permès de tenir segons la mecànica quàntica (en aquest model no és considerat el spin). Un electró del nivell n pot tenir per a l els valors l = n-1, n-2, ... 0, i, fixat l, ml pot tenir els valors ml = -l, -l +1, ... l-1, l. Els diferents estats dels electrons, caracteritzats per n, l i ml formen els diferents orbitals, concepte que subsitueix el de les òrbites de Bohr.
Àtoms polielectrònics
Gràcies a una modificació del model quàntic de l’àtom d’hidrogen hom pot tenir una idea de la configuració electrònica d’un àtom de nombre atòmic Z. En aquest cas l’energia depèn dels dos nombres quàntics n i l. Un electró és caracteritzat per quatre nombres quàntics: n, l, ml i ms; ms , nombre quàntic de spin, només pot tenir els valors 1/2 o -1/2. Els electrons es diposen de forma progressiva en els successius orbitals, tot atenent al principi d’exclusió de Pauli. Per a un mateix valor de n , hi ha diferents orbitals l, l= 0, ..., n-1. Els orbitals l s’anomenen amb lletres: s (l = 0), p (l = 1), d(l = 2), f (l = 3). Un orbital s només pot tenir dos electrons (ml = 0, ms = ±1/2); un p pot tenir-ne sis (ml = -1, 0, 1, ms = ±1/2); un d pot tenir-ne deu (l = -2, -1, 0, 1, 2, ms = ±1/2). De la disposició dels electrons en aquests orbitals resulta la configuració electrònica de l’element en qüestió. Les diferents configuracions, i especialment la diferent completesa dels nivells més externs, són els responsables dels distints comportaments dels elements químics.