Resultats de la cerca
Es mostren 35 resultats
pes fórmula
Física
Química
Suma dels pesos atòmics dels àtoms que intervenen en la fórmula més simple d’una substància.
El pes molecular és un múltiple exacte del pes fórmula A algunes substàncies que no contenen molècules diferenciades, hom assigna pes fórmula però no pes molecular, com és el cas del clorur de sodi En el cas del benzè, per exemple —una anàlisi elemental del qual demostra que la fórmula més simple és CH—, el pes fórmula serà 13,02, suma dels pesos atòmics del carboni i de l’hidrogen Això no obstant, l’estructura de cada molècula de benzè és hexagonal, per la qual cosa la seva fórmula veritable és C 6 H 6 i el seu pes molecular és 78,11
integral de ressonància
Química
Integral definida en l’estudi mecanicoquàntic de l’estructura molecular.
La integral queda definida per β = ∫φ 1 Hφ 2 d τ = ∫φ 2 Hφ 1 d τ essent φ 1 i φ 2 dos orbitals atòmics diferents, i H l’hamiltonià del sistemaÉs un dels components de l’energia electrònica en l’estudi d’aquesta pel mètode dels orbitals moleculars El seu valor és sempre negatiu, i el seu significat físic és el d’una estabilització addicional del sistema a causa de la deslocalització d’un parell electrònic entre els orbitals atòmics φ 1 i φ 2
orbital molecular
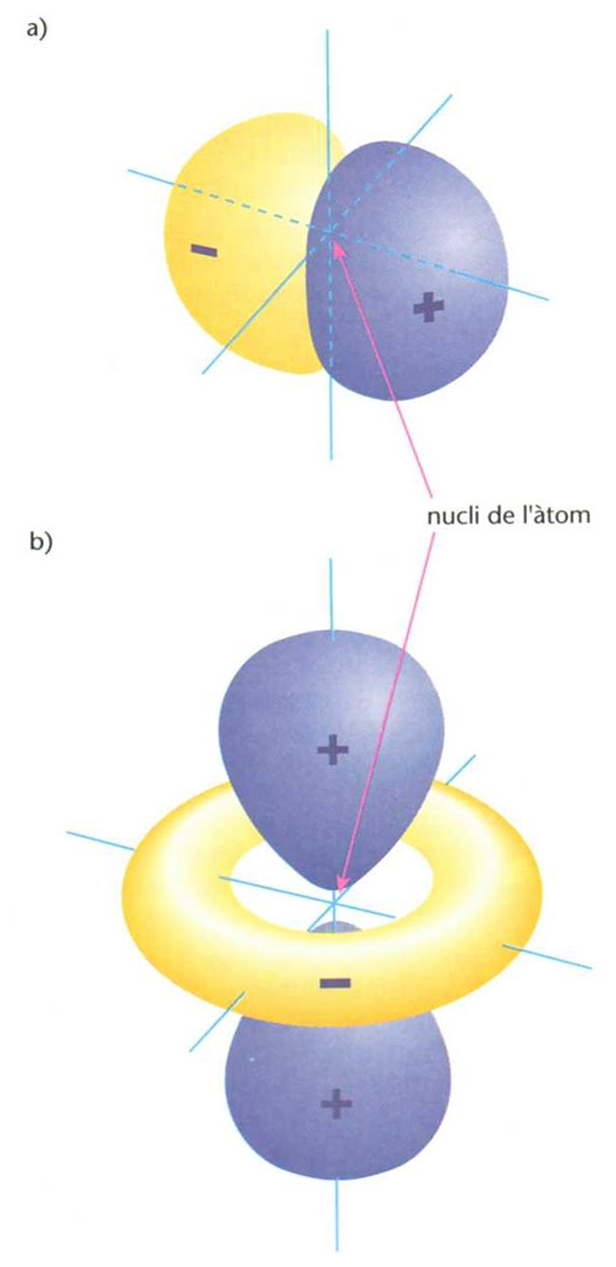
Representació tridimensional de dos orbitals (de nombres quàntics n=2,l = 1 (p) i m=1(a), i n =3,l = 2 (d) i m = 0 (b)) de l’àtom d’hidrogen en prèsencia de camp magnètic extern: assenyalen dos estats energètics de l’electró i la regió al voltant del nucli on és més probable de trobar l’electró en cadascun d’aquests dos estats (els valors de l i m determinen les dimensions, la forma i l’orentació de l’orbital): els caolors respresenten els signes + o - que pren la funció d’ona
© Fototeca.cat
Química
Cadascuna de les funcions d’ona, solució de l’equació de Schrödinger, associades a un electró que forma part d’una molècula.
Presenten les mateixes característiques matemàtiques que els orbitals atòmics Són de natura policèntrica i constitueixen en ells mateixos una interpretació de l’enllaç químic La descripció de l’estructura molecular mitjançant l’ús d’orbitals moleculars és coneguda com a teoria de l’enllaç dels orbitals moleculars , i consisteix a considerar inicialment la molècula com un conjunt de nuclis amb ordenació pròpia, determinar els diversos orbitals de nuclis i omplir els orbitals multicèntrics així obtinguts amb els electrons de la molècula, mitjançant un procediment anàleg al seguit…
Eilhard Mitscherlich
Química
Químic alemany.
Descobrí el fenomen de l’isomorfisme 1819 en observar que els fosfats i els arseniats d’un mateix metall poden adquirir la mateixa forma cristallina El 1826 ideà procediments adequats per a determinar directament els pesos atòmics dels elements
Jöns Jakob Berzelius
Química
Químic suec.
Estudià medicina a la Universitat d’Uppsala, i fou professor de medicina i farmàcia al Karoline Institute d’Estocolm, alhora que formava un nombrós grup de científics —Friedrich Wöhler, Carl Gustav Mosander, Alexander Mitscherlich— en les tècniques de l’anàlisi química Exercí el seu mestratge damunt el món científic a través dels seus Rapports annuels sur les progrès des sciences physiques et chimiques, que publicà durant vint-i-set anys Fou el descobridor del seleni, el ceri i el tori, i el primer a isolar el calci, l’estronci, el bari, el tàntal, el silici, el vanadi i el zirconi La part…
Theodore Williams Richards
Química
Químic nord-americà.
Professor a Harvard, treballà en electroquímica i termodinàmica química i ideà un tipus de calorímetre adiabàtic És conegut sobretot pel fet d’haver determinat nombrosos pesos atòmics d’elements i pel fet d’haver confirmat l’existència de diferents isòtops El 1914 rebé el premi Nobel de química
anàlisi isotòpica
Química
Determinació de l’abundància relativa dels diversos isòtops d’un cert element en un producte donat.
L’anàlisi isotòpica utilitza, bé les propietats que depenen només de la diferència de massa entre els isòtops mesura de densitats, mesura de conductibilitat tèrmica de gasos, espectrometria de massa, mesura de les freqüències espectrals característiques en els espectres atòmics i moleculars, bé les propietats intrínsecament nuclears ressonància magnètica nuclear i, en el cas dels isòtops radioactius, detecció i mesura de la radiació emesa
Johann Wolfgang Döbereiner
Química
Químic alemany, professor de química a la Universitat de Jena (1810).
A través de l’estudi de les propietats i els pesos atòmics dels elements químics coneguts a la seva època n'establí una classificació, agrupant-los segons llurs similituds en les anomenades tríades de Döbereiner Aquesta classificació estimulà ulteriors investigacions, que culminaren en l’establiment del sistema periòdic dels elements Amic íntim de Goethe, fou el seu consultor sobre els treballs químics que féu aquest darrer
enllaç
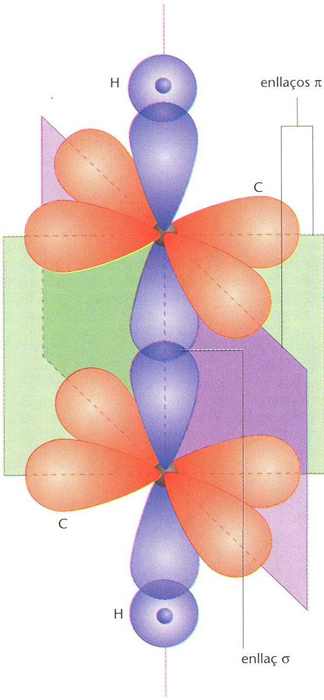
Superposició d’un enllaç δ i dos enllaços π amb plans nodals perpendiculars, en una molècula d’etí o acetilè (CH ≡CH)
© Fototeca.cat
Química
Interacció entre dos o més àtoms el resultat de la qual és la formació d’un compost, és a dir, d’un agregat que és estable dins un cert interval de temperatures i pressions.
La natura de les forces que donen lloc a l’enllaç químic fou objecte de moltes especulacions ja Demòcrit suposava que els àtoms eren ganxuts, però restà forçosament desconeguda fins a l’establiment de la constitució de l’àtom Ben abans, JJ Berzelius i S Arrhenius pressentiren, tanmateix, que es tractava de forces elèctriques Actualment hom sap que l’enllaç resulta de les forces de Coulomb entre les càrregues elèctriques positives i negatives del nucli i els electrons La petitesa de la massa dels constituents atòmics, i en especial de l’electró, fa que només els sigui aplicable la mecànica…
Stanislao Cannizzaro
Química
Químic italià.
Participà, a Sicília, en la revolució del 1848 i s’hagué d’exiliar a París Fou professor 1851 de química a Alessandria Piemont, on descobrí la reacció anomenada de Cannizzaro , i catedràtic a les universitats de Gènova 1855, Palerm 1861 i Roma 1871, i fou senador italià 1871 Desenvolupà mètodes precisos de determinació de pesos moleculars i atòmics basats en la llei d' Avogadro i aconseguí l’acceptació d’aquesta pel món científic de l’època congrés de Karlsruhe, 1860, així com també que fossin unificats els criteris de formulació dels composts químics Demostrà que la química…