Resultats de la cerca
Es mostren 5 resultats
polarímetre
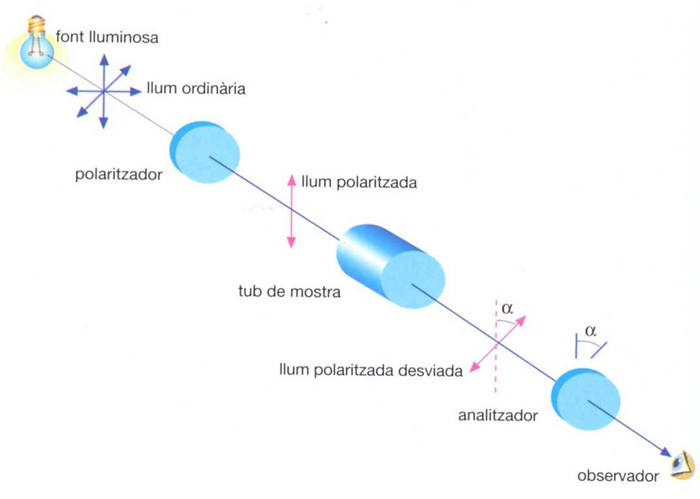
Esquema bàsic d’un polarímetre
© Fototeca.cat
Física
Química
Instrument per a mesurar la rotació del pla de vibració de la llum polaritzada en travessar un medi òpticament actiu.
Consta fonamentalment d’una font lluminosa que emet radiació monocromàtica, generalment una làmpada de vapor de sodi, un polaritzador, constituït per un prisma de Nicol o un polaroide, el qual transforma la llum ordinària en polaritzada, un tub situat en la direcció de propagació de la radiació, el qual conté la mostra, i un analitzador, constituït generalment per un altre prisma de Nicol El funcionament d’un polarímetre simple és el següent quan el tub per a la mostra és buit, es transmet un màxim de llum a través de l’analitzador quan aquest és alineat amb el polaritzador En collocar en el…
biamperometria
Química
Tècnica electroanalítica de detecció del punt final d’una volumetria, relacionada amb l’amperometria i basada en l’ús de dos microelèctrodes inerts polaritzats, entre els quals hom aplica una petita diferència de potencial (potencial de polarització).
Si la solució que hom valora conté els dos membres d’un parell redox reversible —per exemple, iode-iodur, ions ferroII-ferroIII, etc—, aquesta diferència de potencial és suficient per a provocar el pas d’un corrent elèctric detectable en un galvanòmetre muntat entre els microelèctrodes, en un dels quals té lloc la reducció i en l’altre l’oxidació del parell mencionat, corrent que s’anulla, en el moment del punt final, quan desapareix de la solució un dels dos membres del parell Quan el parell redox present en la solució problema és irreversible, no passa corrent durant la valoració, però la…
coulombimetria
Química
Tècnica electroanalítica basada en la mesura de la quantitat d’electricitat necessària per a convertir quantitativament, per electròlisi, un component de la substància problema en una altra substància.
La quantitat de component és calculada per les lleis clàssiques de Faraday, però cal garantir que el rendiment de corrent en el procés electròdic sigui del 100% La transferència d’electrons entre l’elèctrode i el component problema pot tenir lloc directament o indirectament, mitjançant un reactiu generat electrolíticament que reaccioni quantitativament amb la substància problema El procediment rep aleshores el nom impropi de volumetria conductimètrica La coulombimetria és practicada segons dues tècniques diferents a potencial controlat a un valor adequat perquè reaccioni només l…
bescanvi iònic
Química
Procés químico-físic segons el qual, en posar en contacte una solució iònica amb un compost immiscible de constitució adequada, anomenat bescanviador iònic
, es produeix la fixació en aquest dels cations o dels anions de la dita solució, en canvi, respectivament, de quantitats equivalents de cations o d’anions procedents del bescanviador, que són alliberats del seu reticle i passen a la solució.
El bescanvi pot ésser, doncs, catiònic o aniònic , segons el signe de la càrrega dels ions bescanviats Hom pot dur a terme, a la pràctica, el procés de bescanvi iònic segons dues tècniques principals totalments diferents operació en banys discontinus i operació per percolació en columna En la primera, hom addiciona una quantitat de bescanviador a la solució que hom ha de tractar i l’agita fins que assoleix l’equilibri entre les dues fases D’acord amb la llei d’acció de masses, la solució final conté sempre, encara, una certa concentració de l’ió inicial, ensems amb l’ió procedent del…
aigua
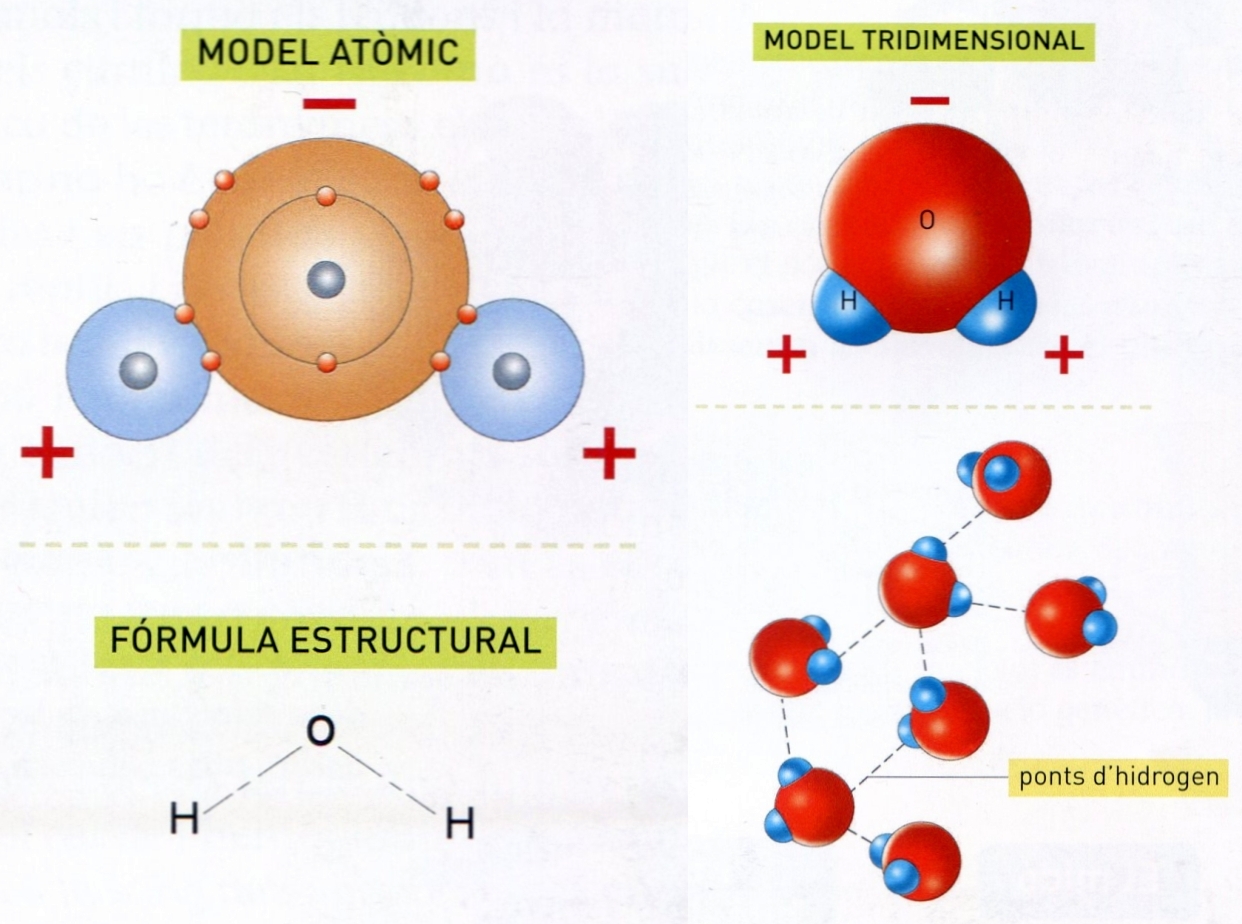
La molècula d’aigua
© Fototeca.cat
Química
Compost d’hidrogen i oxigen de fórmula H2O; atesos el seu paper a la natura i els seus innombrables usos, és la més important de totes les substàncies i fou considerada durant segles com un element.
Propietats fisicoquímiques de l’aigua Composició La seva composició fou establerta per síntesi per Cavendish el 1781 fent explotar una mescla d’hidrogen i oxigen 2H + O 2 → 2H 2 O L’anàlisi fou feta per Lavoisier i Meusnier, el 1783, descomponent el vapor amb ferro roent 4H 2 O + 3Fe → Fe 3 O 4 + 4H 2 La descomposició electrolítica H 2 O 2 + ½O 2 fou realitzada per primera vegada per Nicholson i Carlisle l’any 1800 La represa d’aquests experiments amb mètodes més precisos permeté de determinar exactament la composició ponderal, establir la fórmula definitiva i confirmar les lleis…