Resultats de la cerca
Es mostren 8 resultats
equivalent gram
Química
Pes en grams d’una substància que desplaça 8 g d’oxigen o 1 g d’hidrogen, o que s’hi combina.
L’equivalent gram ha estat emprat en química analítica per a expressar les concentracions de les solucions normalitat
alcoholimetria
Química
Determinació de la proporció d’alcohol etílic existent en les seves mescles amb aigua, i en els líquids fermentats, mitjançant un alcoholímetre.
Aquesta proporció pot expressar-se en graus alcohòlics Gay-Lussac, en percentatge en pes o encara en sistemes més complicats per exemple els graus proof spirit anglosaxons Quan es tracta de mescles d’etanol i aigua sense altres components, l’alcoholímetre pot ésser utilitzat directament Quan es tracta de líquids alcohòlics complexos, cal efectuar una destillació prèvia
concentració
Química
Quantitat d’una substància en una unitat de mescla, solució o mineral que la conté.
Correntment hom acostuma a expressar la concentració d’una manera general i, en el cas d’una solució, relacionant el solut en pes o en volum i cent parts en pes o en volum de la solució tant per cent en pes o en volum, relacionant el nombre de mols o el d’equivalents de solut i un litre de la solució molaritat i normalitat, respectivament, relacionant el nombre de mols de solut i un quilogram del solvent molalitat o bé relacionant el nombre de mols d’un component de la solució i el nombre total de mols dels components fracció molar
solubilitat
Química
Pel que fa a substàncies sòlides o líquides, pes de substància continguda en una solució en equilibri amb la substància pura no dissolta a una temperatura donada.
En aquestes condicions, hom diu que la solució és saturada Hom expressa normalment la solubilitat en grams de solut per cent grams de solvent La solubilitat de sòlids i líquids en un solvent determinat varia amb la temperatura — augmenta generalment amb aquesta— i depèn principalment de llurs respectives natures químiques dissolució Pel que fa a les substàncies gasoses, relació entre la concentració del gas en la solució i la concentració del gas sobre la superfície de la solució a una temperatura determinada llei de Henry Hom sol expressar-la en millilitres de gas per litre…
acidesa
Química
Indicació quantitativa de les propietats àcides.
L’acidesa d’un àcid HA en un solvent amfipròtic S, o sigui, la seva força en aquest solvent, ve mesurada per la seva tendència a cedir un protó al solvent, és a dir, per la constant d’acidesa K A expressió on a i és l’activitat de l’espècie i i K és la constant de l’equilibri HA + S ⇌ HS + + A - La força d’un àcid depèn, doncs, del solvent En general, resulta còmode d’expressar l’acidesa en unitats logarítmiques, i per obtenir nombres positius hom pren el logaritme de la inversa de K A , que és representat pel símbol pK A pK A = - log K A Com més elevada és l’acidesa, és a dir…
velocitat de reacció
Física
Química
Variació amb el temps de la concentració d’un dels reactius o dels productes que intervenen en una reacció química.
En general, la velocitat d’una reacció química depèn, a temperatura i pressió determinades, de la natura i la concentració dels reactius, mitjançant una constant numèrica coneguda com a constant de velocitat , la qual és alhora funció de la temperatura L’estudi de les velocitats de reacció pot ésser abordat des d’un punt de vista microscòpic o macroscòpic En l’anàlisi microscòpica hom estudia fonamentalment l’evolució de la constant de velocitat amb la temperatura Històricament, el primer intent de relacionar la constant de velocitat amb la temperatura fou fet per SArrhenius mitjançant la…
al·lo-
Química
Prefix usat algun cop per a designar l’un de dos o més isòmers (sovint geomètrics), especialment quan és difícil expressar-ne breument l’estructura o quan aquesta no fou establerta en descobrir-lo.
Molts noms trivials de composts orgànics comencen, tanmateix, per allo, sense que això impliqui cap referència a isomeria
àcid
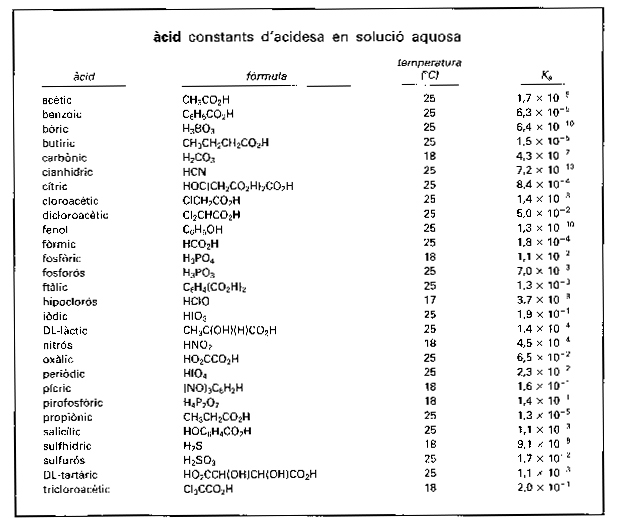
Constants d’acidesa en solució aquosa
Química
Cada una de les substàncies caracteritzades químicament pel fet de provocar canvis de color en les substàncies anomenades indicadors i de reaccionar molt ràpidament amb les substàncies d’un altre grup anomenades bases.
Les propietats típiques d’ambdós reactius desapareixen pel fet de la reacció, cosa que és interpretada com una neutralització mútua dels àcids i de les bases que dóna composts neutres tals com, per exemple, les sals Aquestes dues propietats essencials van acompanyades, en general, d’altres de menys fonamentals i no sempre presents, com el sabor àcid, l’activitat catalítica i la propietat —en solució aquosa— de dissoldre certes substàncies insolubles com els carbonats i molts metalls A més, els àcids i les bases poden desplaçar-se mútuament de llurs composts correlativament a…