Resultats de la cerca
Es mostren 6 resultats
antiozonant
Química
Dit de les substàncies utilitzades per a reduir o evitar l’enèrgica acció oxidant de l’ozó.
Els antiozonants són emprats, sobretot, per a protegir el cautxú, natural o sintètic, i consisteixen en ceres de petroli microcristallines o amorfes, que actuen físicament interposant una pellícula protectora, en amines secundàries aromàtiques tals com la N, N 1 -difenil-ρ-fenilendiamina o la quinolina, i en derivats furànics
subnitrat de bismut
Química
Pólvores blanques, formades per cristalls molt petits, inodores, quasi insípides, insolubles en aigua i en alcohol.
La seva fórmula varia segons el procediment emprat per a obtenir-lo L’oficinal ha de contenir el 78% de Bi 2 O 3 És anomenat també nitrat bàsic de bismut Com tots els composts de bismut, té acció antiàcida, absorbent, protectora de les mucoses i cicatritzant de les úlceres de l’aparell digestiu Hom n'ha abandonat l’ús en radiologia a causa de les intoxicacions que es produïen a vegades en ésser descompost pels àcids gàstrics És emprat en la composició de medicaments, en la preparació d’altres sals de bismut, en perfumeria, cosmètica, esmalts ceràmics, etc
indi
Química
Metall del bloc p, grup III, de la taula periòdica; descobert per F.Reich i J.B.Richter el 1863 en una blenda de Freiberg (Alemanya); té els nombres d’oxidació 1, 2, 3.
Les dues ratlles principals del seu espectre se situen en la zona del blau d’indi, d’on li ve el nom L’element natural és una mescla dels núclids 113 4,2% i 115 95,8% hom en coneix divuit núclids artificials 107, 108, 109, 110 i 110 m, 111, 112 i 112 m, 113 m, 114 i 114m, 115m, 116 i 116m, 117 i 11 m, 118 i 119 Hom el troba en els minerals de zinc, de plom i d’estany, en un percentatge inferior al 0,1% D’aspecte semblant al del zinc, és un metall molt malleable, no tan dur com el plom i bastant dúctil Estable a l’aire lliure a la temperatura ordinària, l’indi crema en calent dins l’oxigen no…
coure
Coure
© Fototeca.cat-Corel
Química
Element de transició, situat entre els blocs s i p de la taula periòdica i pertanyent al grup dels metalls nobles.
L’afinament electrolític és, però, el procediment més corrent la solució electrolitzada conté d’un 15 a un 20% de sulfat de coure CuSO₄, 5H₂O i del 5 al 8% d’àcid sulfúric els ànodes de coure brut i els càtodes de coure pur són disposats en parallel dins una cella electrolítica els metalls més electropositius que el coure són solubilitzats, el plom precipita en forma de sulfat i els metalls nobles constitueixen el fang anòdic juntament amb el sofre, el seleni i el telluri El coure catòdic té un grau de puresa elevat des del 99,9% fins al 99,98%, però conté gasos, i per això, ha d’ésser refós…
cobalt
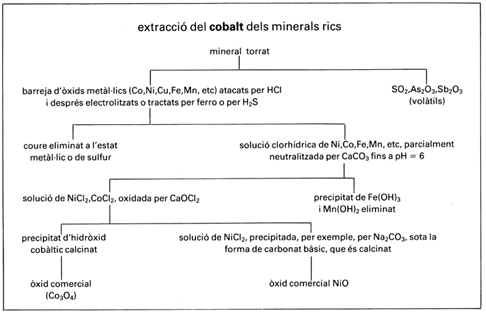
Extracció del cobalt de minerals rics
Química
Tecnologia
Element de transició del bloc d, situat entre els elements del bloc s i els del bloc p de la taula periòdica; el nom li ve de l’alemany kobold, que significa ‘fetiller’.
Té un sol isòtop natural el núclid 59, i 10 núclids artificials 54, 55, 56, 57, 58 i 58 m, 60 i 60 m, 61 i 62 Metall blanc, dúctil i malleable, descobert per Georg Brandt el 1735 Graus d’oxidació del coballt el +3, el +2, que és l’únic estable per a les sals simples en solució, el +1, que ha estat assenyalat per Manchot el 1926, i el +4, que es dóna segurament en l’òxid CoO 2 i en alguns complexos N’hi ha dues varietats allotròpiques la varietat α, que cristallitza en el sistema hexagonal compacte c/a = 1,6, estable a les temperatures ordinàries i que es transforma lentament per sobre de 450…
aigua
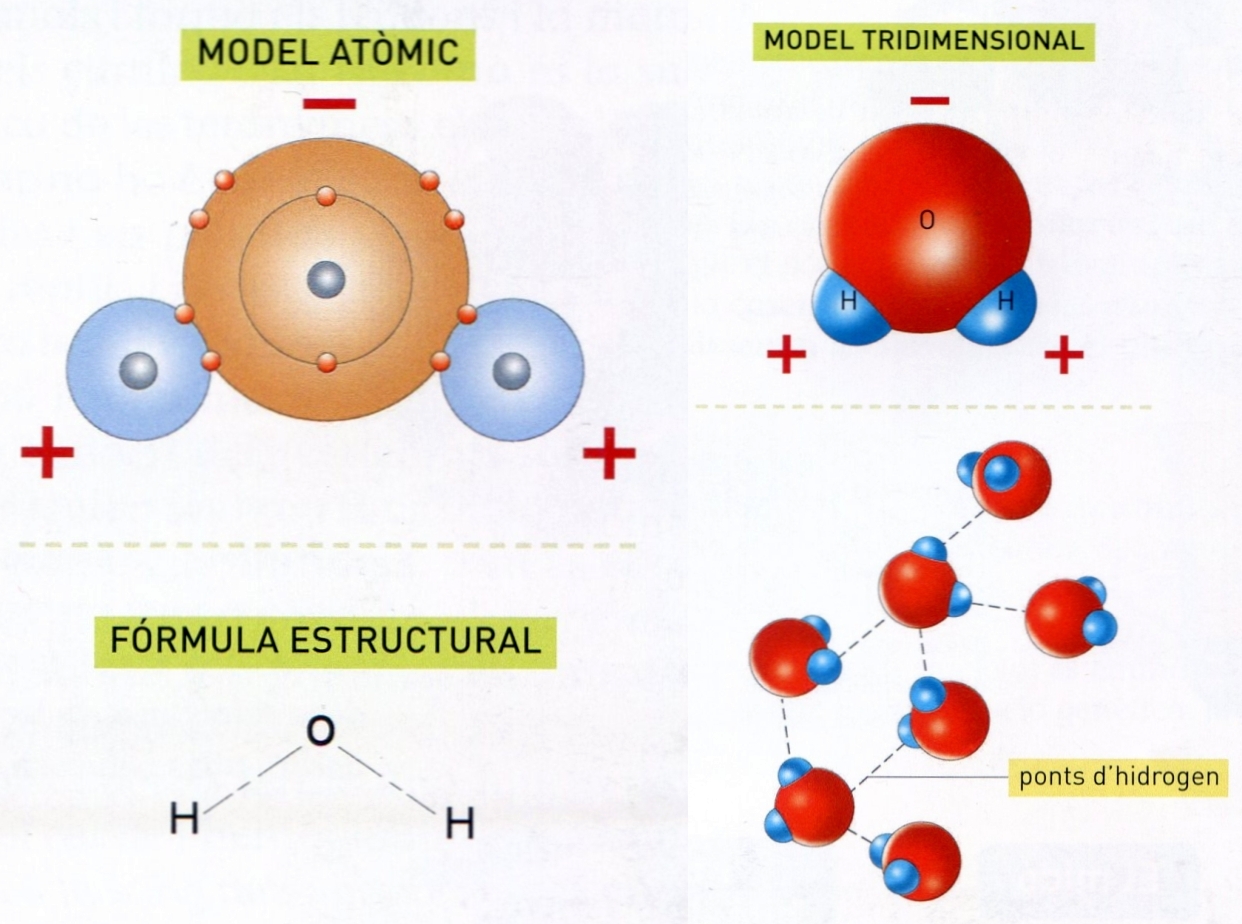
La molècula d’aigua
© Fototeca.cat
Química
Compost d’hidrogen i oxigen de fórmula H2O; atesos el seu paper a la natura i els seus innombrables usos, és la més important de totes les substàncies i fou considerada durant segles com un element.
Propietats fisicoquímiques de l’aigua Composició La seva composició fou establerta per síntesi per Cavendish el 1781 fent explotar una mescla d’hidrogen i oxigen 2H + O 2 → 2H 2 O L’anàlisi fou feta per Lavoisier i Meusnier, el 1783, descomponent el vapor amb ferro roent 4H 2 O + 3Fe → Fe 3 O 4 + 4H 2 La descomposició electrolítica H 2 O 2 + ½O 2 fou realitzada per primera vegada per Nicholson i Carlisle l’any 1800 La represa d’aquests experiments amb mètodes més precisos permeté de determinar exactament la composició ponderal, establir la fórmula definitiva i confirmar les lleis…