Resultats de la cerca
Es mostren 23 resultats
afinitat
Química
Tendència d’una mescla de substàncies a reaccionar químicament, que ve mesurada per la disminució de l’energia lliure de Gibbs que la reacció, a temperatura i a pressió constants, provoca.
Històricament, bé que el mot havia estat utilitzat en un sentit similar des de més antic Albert Magne, la noció d’afinitat és a dir, d’‘inclinació’ mútua de les substàncies que reaccionen fou introduïda per tal d’explicar els fenòmens químics al segle XVIII, i popularitzada especialment per Boerhaave Per als químics de l’època, l’afinitat era la força desconeguda que provocava i mantenia la unió dels àtoms, i durant molts anys un gran esforç especulatiu fou fet per identificar-la Primerament, seguint el suggeriment de Newton, hom considerà que era una manifestació més de les…
fluoroacetat
Química
Cadascun dels derivats de l’àcid fluoroacètic (CH2FCOOH).
Tant aquest àcid com els seus derivats es descomponen a l’interior de l’organisme i alliberen àcid fluorhídric D’ací ve que tots siguin substàncies molt tòxiques, que actuen com a metzines retardades, d’acció convulsiva El fluoroacetat sòdic és emprat com a raticida, conegut com a “1 080”
acidesa
Química
Indicació quantitativa de les propietats àcides.
L’acidesa d’un àcid HA en un solvent amfipròtic S, o sigui, la seva força en aquest solvent, ve mesurada per la seva tendència a cedir un protó al solvent, és a dir, per la constant d’acidesa K A expressió on a i és l’activitat de l’espècie i i K és la constant de l’equilibri HA + S ⇌ HS + + A - La força d’un àcid depèn, doncs, del solvent En general, resulta còmode d’expressar l’acidesa en unitats logarítmiques, i per obtenir nombres positius hom pren el logaritme de la inversa de K A , que és representat pel símbol pK A pK A = - log K A Com més elevada és l’acidesa, és a dir…
actinisme
Fotografia
Química
Capacitat de l’energia radiant d’induir transformacions químiques.
L’actinisme de la llum modifica, per exemple, l’estructura química de les emulsions fotogràfiques i dóna lloc després del revelat a la formació d’una imatge L’actinisme d’una llum ve determinat per la seva intensitat i la seva composició espectral i és definit sempre en relació amb el material que hi és sensible Les transformacions induïdes per l’actinisme són estudiades per la fotoquímica
hidròxid d’alumini
Química
Sòlid blanc, gelatinós, obtingut amb quantitats variables d’aigua per reacció d’una sal soluble d’alumini amb un hidròxid, carbonat o sulfur alcalí.
Existeix en dues formes cristallines polimorfes, amorf i colloidal gel d’alúmina Té propietats amfòteres, i la seva acidesa i la seva basicitat són pràcticament idèntiques pk a = 12,6, pk b = 12 Amb els àcids dóna sals d’Al 3 + amb els hidròxids alcalins, aluminats Quan és precipitat d’una solució que conté un colorant, adsorbeix el colorant tot formant una laca, d’on ve la seva utilització com a mordent en els tints
cromat
Química
Qualsevol sal de l’àcid cròmic.
En dissolució els cromats tenen un color groc, a causa de la presència de l’ió cromat Estructuralment hi ha una analogia entre el cromat i el sulfat Són isomorfes les sals d’ambdós anions quan tenen un catió comú La dissolució aquosa d’un cromat té un caràcter bàsic degut al pas de cromat a dicromat per hidròlosi, segons la reacció En solució àcida l’equilibri és completament desplaçat cap a la dreta d’aquí ve que hom obtingui els dicromats tractant un cromat amb àcid
hidrur de calci
Química
Sòlid de color blanc, de caràcter salí, insoluble en dissolvents orgànics, obtingut per síntesi directa dels seus elements.
El producte comercial és d’un color gris més o menys rogenc És descompost per l’aigua en una reacció hidrolítica de la qual resulta hidròxid de calci i hidrogen molecular D’aquí ve que sigui conegut també amb els noms d' hidrolita i hidrogenita , i és emprat per a transportar i produir quantitats petites d’hidrogen La seva gran reactivitat amb l’aigua el fa un dels agents dessencants més enèrgics, superior a l’anhídrid fosfòric, especialment avantatjós en la indústria per a dessecar els olis de condensadors i transformadors D’altra banda, el seu alt poder reductor és posat a contribució en l’…
pintura anticorrosiva
Química
Pintura destinada a protegir les superfícies metàl·liques de la corrosió produïda per la intempèrie (pintura antirovell), l’aigua de mar, els productes químics, etc.
Atesa la magnitud de les destruccions causades per la corrosió, les pintures anticorrosives tenen gran improtància econòmica Llurs principals característiques són adherència excellent, impermeabilitat a l’aigua i als ions i aptitud a tapar perfectament els porus i anngractuositats del metall En general, per a obtenir bons resultats, cal aplicar-les sobre superfícies perfectament netes sorrejades, desoxidades, etc Els pigments i lligants utilitzats depenen del medi corrosiu contra el qual cal efectuar la protecció En les pintures destinades, per exemple, a la indústria química, cal que el…
convenció de Fischer
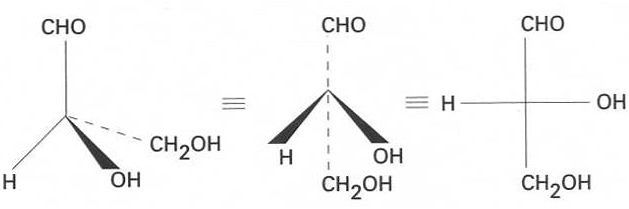
Convenció de Fischer
©
Química
Conveni mitjançant el qual hom representa l’àtom de carboni de manera que les seves valències vagin dirigides cap al darrere (línia de punts), mentre que les valències dels altres substituents van cap al davant (línia gruixuda).
Cal que la funció més oxidada resti a la part superior de la fórmula projectada Atesa l’estructura tetraèdrica de l’àtom de carboni, hi pot haver distintes configuracions d’un mateix compost estereoisomeria d’aquí ve que la convenció de Fischer estableixi un criteri per tal de representar diverses configuracions en un pla Aquestes fórmules de projecció de Fischer no representen fórmules planes, sinó que són la projecció plana d’una fórmula tridimensional Només són vàlides en el pla en què han estat projectades, és a dir, hom no les pot aixecar d’aquest…
mètode de Fischer
Química
Procediment químic d’anàlisi de traces d’aigua.
Aquest mètode es basa en el fet que l’anhídrid sulfurós no redueix el iode amb una solució de metanol i piridina, segons una reacció estequiomètrica, si no és en presència d’aigua La reacció de base és 2H 2 O + SO 2 + I 2 → SO 4 H 2 + 2IH o més exactament segons la reacció final següent La piridina base orgànica dèbil és indispensable per a neutralitzar les quantitats d’àcid en excés, puix que la primera reacció és reversible quan la quantitat d’àcid passa del 0,05% D’aquí ve la possibilitat de calcular la quantitat d’aigua d’una mescla per la mesura de…