Resultats de la cerca
Es mostren 7 resultats
nombre de Prandtl
Física
Coeficient sense dimensions, emprat en els càlculs termodinàmics d’un fluid sotmès a convecció forçada o natural, que representa la relació entre el producte de la capacitat calorífica a pressió constant cpper la viscositat absoluta μdel fluid i la seva conductivitat tèrmica k.
Hom l’expressa per Pr = cp μ /k
adiabàtic | adiabàtica
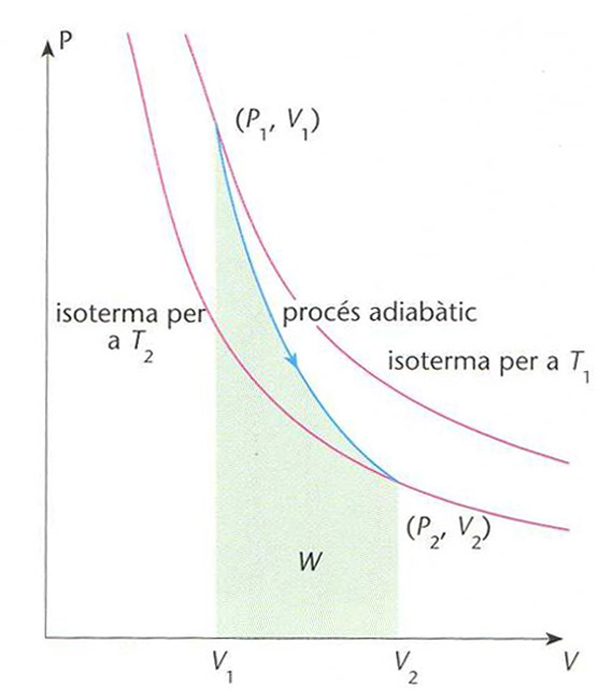
Comparació de l’evolució de la pressió P d’un gas ideal en funció del volum V, entre un procés adiabàtic (línia blava) i un d’isotèrmic (línies vermelles)
© fototeca.cat
Física
Dit del procés temodinàmic en el qual no hi ha intercanvi de calor entre el sistema considerat i l’exterior.
En un procés adiabàtic reversible l' entropia del sistema es manté constant Qualsevol compressió o expansió d’un fluid que es realitzi en un temps molt curt per exemple, expansió del vapor en una turbina pot ésser considerada adiabàtica En un gas ideal, un procés adiabàtic és regit per la relació p V γ =constant essent p , la pressió V , el volum, γ = Cp /C v Cp , la calor molar a pressió constant C v , la calor molar a volum constant mentre que per a un procés isotèrmic es compleix pV…
coeficients calorimètrics
Física
Coeficients que expressen la quantitat de calor rebuda per la unitat de massa d’un cos en funció de les variacions de pressió P, volum V i temperatura T, quan una d’elles roman constant.
Són la calor específica a pressió constant Cp , la calor específica a volum constant C v , la calor d’augment de pressió isoterma h , la calor de dilatació isoterma l i els coeficients, sense nom propi, λ i μ La calor rebuda per un sistema que experimenta unes variacions infinitesimals δ P , δ V i δ T és δ Q = C v δ T + l δ V , δ Q = C v δ T + h δ P i δ Q = λδ P +μδ V L’equació d’estat, fP,V,T=0, permet d’expressar tots els coeficients calorimètrics en termes de només C v i…
llei de Poisson
Física
Relació que compleix un gas ideal en un procés adiabàtic.
Hom l’expressa per pV γ = constant, essent p la pressió, V el volum, i γ = Cp /C v , quocient entre les calors molars del gas a pressió i volum constants
coeficient de Joule-Thomson
Física
Coeficient que expressa la variació de la temperatura d’un gas quan, en condicions adiabàtiques (entalpia constant), és sotmès a un procés d’expansió.
És donat per on P, V, T són la pressió, el volum i la temperatura, H l’entalpia i Cp la calor específica a pressió constant La temperatura a la qual μ J T =0, a una pressió determinada, és anomenada temperatura d’inversió
termodinàmica
Física
Branca de la física que fa servir la mecànica estadística per a estudiar el comportament macroscòpic de la matèria.
Així com la mecànica analitza el moviment d’un sistema material com si fos format per punts discrets, la termodinàmica fa l’estudi estadístic d’un nombre molt elevat de partícules i determina els valors mitjans de les magnituds que el caracteritzen Les propietats termodinàmiques de la matèria poden ésser deduïdes de les lleis de la mecànica estadística en allò que es refereix al comportament ideal dels cossos, i de paràmetres experimentals i fórmules empíriques quan cal tenir en compte les desviacions respecte a les hipòtesis ideals La mesura de la temperatura, la pressió o el volum específic…
fase
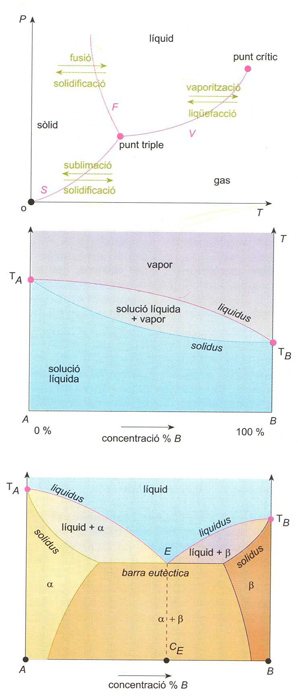
Diagrama de fases: (a) d’un sistema d’un sol component (F, corba de fusió; S, corba de sublimació; V, corba de vaporització); (b) d’un sistema binari líquid-vapor (TA i TB. punts d’ebullició d’A i B); (c) d’un sistema binari solid-líquid eutèctic (TA i TB. punts de fusió d’A i B); E punt eutèctic; CE, composició eutèctica: α i β són les dues fases sòlides que es presenten
© Fototeca.cat
Física
Química
Part d’un sistema, formada per un nombre qualsevol de components, homogènia i amb uns límits ben determinats que la separen de les altres parts del sistema i de la resta de l’univers.
La noció de fase generalitza la d’estat físic sòlid, líquid, gasós i permet distincions més subtils, com la que hi ha entre dues formes de cristallització d’un sòlid Els components d’un sistema són les substàncies que l’integren, i els constituents són les diferents fases que el formen Si només hi ha una fase, el sistema és homogeni , i si n’hi ha més, heterogeni El pas de la fase sòlida a la líquida és anomenat fusió , el de la líquida a la gasosa, vaporització , i el de la sòlida a la gasosa, sublimació Aquests canvis de fase són progressius , i els canvis en sentit contrari són anomenats…