Resultats de la cerca
Es mostren 18 resultats
equació de Nernst
Química
Expressió matemàtica deduïda per Walther Hermann Nernst que relaciona el potencial d’elèctrode amb l’activitat de les espècies químiques que intervenen en la reacció de transferència electrònica, d’equació general Ox + ne = Red, i que té la formaR essent la constant dels gasos, T la temperatura absoluta, n el nombre d’electrons, F la constant de Faraday, aOx i aRed les activitats de les formes oxidada i reduïda, i E° (anomenat potencial estàndard de reducció) una constant característica del parell redox.
efecte Nernst
Electrònica i informàtica
Força electromotriu creada en un medi quan un flux calorífic travessa perpendicularment les línies de força d’un camp magnètic.
Aquesta força, anomenada també termoelectromotriu , té la direcció perpendicular al pla format pel flux calorífic i el camp magnètic
teorema de Nernst
Física
Teorema basat en el teorema de la calor, enunciat per Nernst el 1906 i avalat per l’estadística quàntica (Planck, 1912), que constitueix l’anomenat tercer principi de la termodinàmica: al zero absolut de temperatura, l’entropia d’un cos cristal·lí perfecte és nul·la.
làmpada de Nernst
Electrònica i informàtica
Làmpada d’incandescència amb un filament fet d’òxids metàl·lics (de magnesi o de terres rares), que produeix una llum molt estable i amb abundància de radiacions infraroges.
Actualment desusada com a font lluminosa, és emprada com a patró i en diversos aparells òptics de laboratori, com els espectrofotòmetres
llei de distribució de Nernst
Química
Llei de partició que expressa la distribució en proporcions constants d’un solut, quan és en contacte amb dos líquids immiscibles i soluble en tots dos a una temperatura donada, en el cas que no es doni una associació molecular o una dissociació electrolítica.
electroquímica
Física
Química
Part de la química física que estudia les relacions existents entre l’energia elèctrica i l’energia química.
Hom pot fixar l’origen de l’electroquímica en les experiències d’A Volta, seguides pels treballs de H Davy i M Faraday i la teoria de S Arrhenius sobre els electròlits El 1905 Tafel enuncià l’equació que relaciona la ddp entre dues fases amb la densitat del corrent mesurat El 1890, però, W Nernst ja havia establert l’equació que porta el seu nom i que relaciona la ddp mesurada i l'activitat de l’ió que és en dissolució Butler interpretà cinèticament els potencials de Nernst, Gurney introduí la mecànica quàntica per a explicar la transferència de càrrega i Frunkin…
efecte termogalvanomagnètic
Física
Fenomen que modifica les característiques físiques d’un medi material quan, sota la influència sis d’un camp elèctric o d’un camp magnètic o d’un gradient de temperatura o més d’un d’ells a la vegada, és travessat per un corrent elèctric.
Són efectes termogalvanomagnètics l’efecte Peltier, l’efecte Thomson, l’efecte Leduc-Righi i l’efecte Nernst, entre altres, o una combinació d’ells
fórmula de Boltzmann
Física
Expressió que relaciona l’entropia S d’un sistema (magnitud macroscòpica) i el nombre d’estats microscòpics accessibles pel sistema, W (magnitud microscòpica): S = k lnW, essent k la constant de Boltzmann.
Palesa la connexió entre la termodinàmica clàssica i la mecànica estadística Al zero absolut T = 0 K totes les partícules del sistema són a l’estat fonamental, de manera que W = 1 i, per tant, S = 0, la qual cosa és d’acord amb el tercer principi de la termodinàmica teorema de Nernst
potencial d’elèctrode
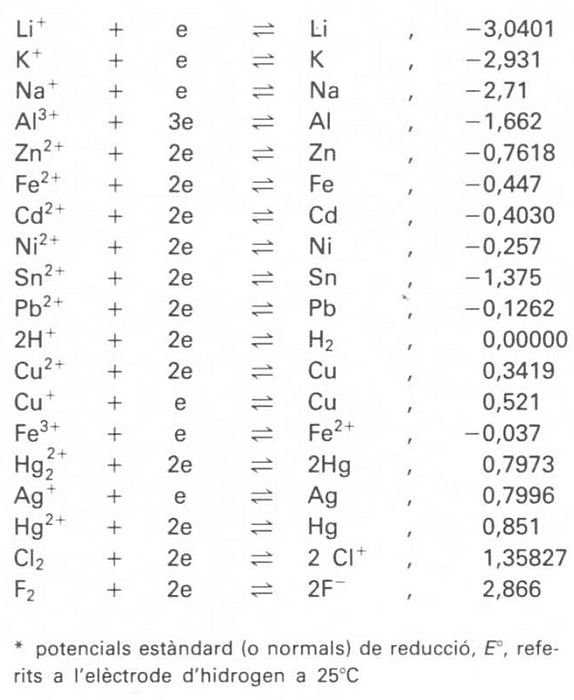
Potencial d’elèctrode
©
Química
Estat d’equilibri elèctric d’una substància (element químic o compost) que és submergida en una dissolució que la conté en forma iònica.
Formalment, és expressat per la equació o llei de Nernst El potencial d’elèctrode d’una substància no pot ésser mesurat d’una manera absoluta, sinó formant una pila amb una altra que és presa com a referència de potencial zero Hom acostuma a prendre com a referència l' elèctrode d'hidrogen o l' elèctrode de calomelans
tercer principi de la termodinàmica
Física
Principi segons el qual en el zero absolut de temperatura la variació d’entropia d’un sistema en un procés isotèrmic tendeix a zero.
Aquest principi emana del teorema de Nernst, enunciat el 1906 i completat per Planck el 1912 amb la hipòtesi que en el zero absolut l’entropia de qualsevol substància sòlida o líquida pura és zero Una conseqüència del tercer principi és que el zero absolut no es pot atènyer amb un nombre finit de transformacions termodinàmiques