Resultats de la cerca
Es mostren 3106 resultats
Joan Ramis i Ramis publica Rosaura o el més constant amor
Joan Ramis i Ramis publica Rosaura o el més constant amor
L’emperador Constant és assassinat a l’Oppidum Helena (Il·liberi, Elna)
Davant la usurpació de Flavi Magne Magnenci a la Gàllia, l’emperador Constant intenta fugir a Hispània, però és atrapat i assassinat a l’Oppidum Helena Illiberi, Elna
corrent continu
Electrònica i informàtica
Corrent elèctric constant.
Té sempre el mateix sentit i la seva intensitat és constant o bé varia lleugerament entorn d’un valor constant formant una petita ondulació Els generadors electroquímics piles, bateries, etc i les dinamos són els principals generadors de corrent continu Per a transformar el corrent altern en continu són emprats els convertidors o, més correntment, els rectificadors Al començament de la utilització de l’energia elèctrica fou emprat el corrent continu per a les xarxes de distribució, però actualment és emprat exclusivament el corrent altern, i el corrent continu només…
isopícnic | isopícnica
Geografia
Dit de la superfície de densitat constant.
Semblantment al cos de la temperatura isotermes i de la salinitat isohalines, la representació gràfica de les superfícies de densitat constant dóna informació sobre l’estructura horitzontal i vertical de les masses d’aigua a l’oceà
baroclinitat
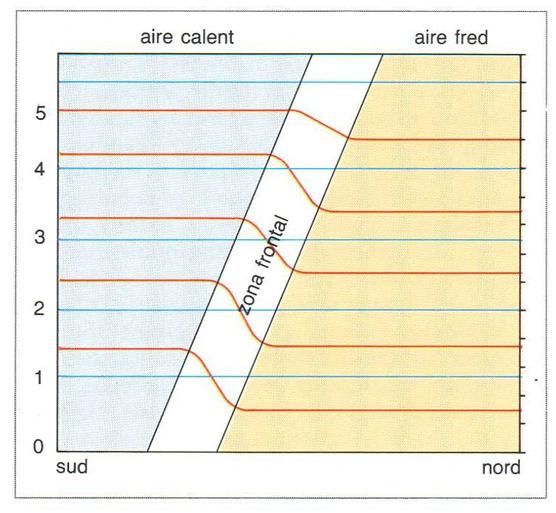
Tall del gràfic de baroclinitat de l’atmosfera terrestre: les ordenades indiquen l’altura en km; les superfícies de temperatura constant (isotèrmiques, en vermell) i de pressió constant (isobàriques, en blau) són paral·leles en les zones de barotropia d’aire calent (en blau) i d’aire fred (en ocre), i es creuen en les zones de baroclinitat (zona frontal)
© Fototeca.cat
Meteorologia
Estat d’estratificació d’un fluid en què les superfícies de pressió constant s’intersequen amb les superfícies de densitat (o temperatura) constants.
dissolvent polar
Química
Medi constituït per molècules polars i caracteritzat per una constant dielèctrica elevada.
La constant dielèctrica ε i el moment dipolar μ són relacionats per l’equació de Clausius-Mosotti 4π N μ/9 kT = ε-2/ε+1M/d en la qual N és el nombre d’Avogadro, k la constant de Boltzmann, M el pes molecular i d la densitat En general, les variacions de ε i μ són paralleles Els dissolvents polars, que faciliten la separació de càrregues en les molècules que hi són dissoltes gràcies a llur facultat de solvatació de les espècies carregades, exerceixen una acció favorable en les reaccions que impliquen un trencament heterolític d’un enllaç Un ús adequat dels dissolvents…
paracor
Química
Constant pròpia dels líquids, introduïda per S.Sugden el 1924.
És definida per la relació p = Mγ1/4ρ-ρ0- , on M és el pes molecular del líquid en particular, γ és la tensió superficial i ρ i ρ0 són les densitats del líquid i del seu vapor a una temperatura determinada Per a líquids no associats, es manté constant dins un marge ample de temperatures i dóna una mesura del seu volum molar És una propietat additiva i ha estat emprada històricament en l’estudi de l’estructura molecular dels composts
R
Química
Constant de l’equació dels gasos perfectes, coneguda com a constant molar de gas o constant dels gasos, definida per la relació R = Pv/nT, essent P la pressió exercida per un volum V de gas, constituït per n mols, a la temperatura de T kelvins.
Equival a la constant de Boltzmann k multiplicada pel nombre d'Avogadro N A R = kN A El seu valor és de 8,31441 J mol - 1 K - 1
cicle Sabathé
Tecnologia
Cicle mixt entre el cicle d’Otto i el cicle dièsel en el qual, després de la fase de compressió adiabàtica, ve, com en el cicle d’Otto, una fase de combustió a volum constant i, després, com en el cicle dièsel, una fase de combustió a pressió constant.
A igualtat de relació de compressió, el rendiment del cicle Sabathé resulta intermedi entre els cicles d’Otto i dièsel Si hom augmenta la calor subministrada a volum constant i redueix la subministrada a pressió constant, el rendiment tèrmic s’aproxima al del cicle Otto, mentre que si hom redueix la calor subministrada a volum constant i augmenta la corresponent a pressió constant, aleshores el rendiment s’aproxima al del cicle dièsel
equació de Van’t Hoff
Química
Equació que determina la variació de la constant d’equilibri químic K en funció de la temperatura.
Segons l’expressió ∂ln K /∂ T p = Δ H 0 / RT 2 , Δ H 0 essent la variació d’entalpia en la reacció en condicions normals, R la constant dels gasos i T la temperatura absoluta