Resultats de la cerca
Es mostren 7 resultats
cèl·lula voltaica
Química
cel·la electroquímica
destinada a produir energia elèctrica.
Hom l’anomena més correntment element primari o pila
voltaic | voltaica
Electrònica i informàtica
Dit de les piles ideades per A.Volta i de l’electricitat produïda per piles.
Walther Hermann Nernst
Física
Físic i químic alemany.
Professor a la Universitat de Berlín, investigà especialment sobre camps poc coneguts de l’electroquímica difusió dels ions, dissociació electrolítica, nova teoria de la pila voltaica El 1899 establí la relació entre la diferència de potencial de contacte i la pressió osmòtica dels ions en solució El 1906 formulà el teorema que porta el seu nom teorema de Nernst Escriví el tractat de química general Theoretische Chimie 1893, i rebé el premi Nobel de química l’any 1920
Alessandro Volta

Alessandro Volta
© Fototeca.cat
Física
Físic italià.
S’ocupà especialment en el camp de l’electricitat, on feu recerques notables i importants Inventà l’ electròfor 1775 i l’ electroscopi 1782 i feu una sèrie d’experiències destinades a posar en clar les observacions de Galvani sobre l’electricitat animal Enuncià la seva teoria sobre les tensions en els metalls, els quals ordenà segons una sèrie determinada L’any 1800, com a resultat de les seves investigacions, donà a conèixer la primera pila elèctrica, que hom anomenà voltaica i que fou una veritable revolució científica Estudià els gasos dels pantans i ideà l’ eudiòmetre
pila
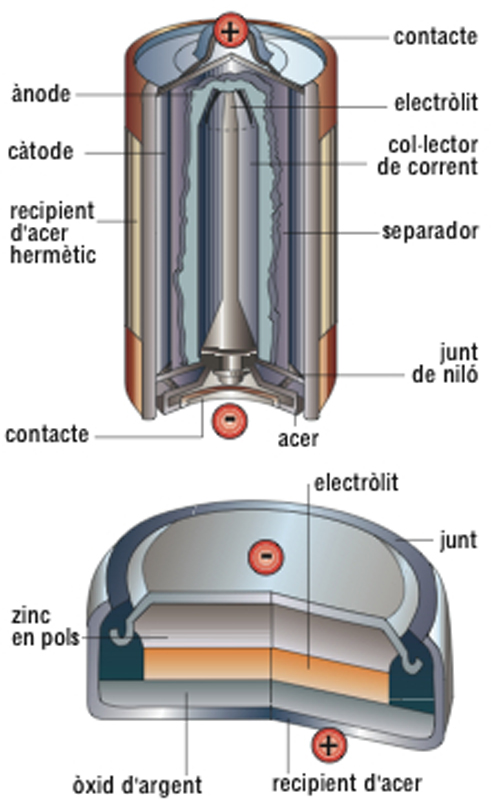
Esquemes d’una pila alcalina (a dalt) i d’una de botó d’òxid d’argent (a baix)
© Fototeca.cat
Química
Generador electroquímic que produeix una tensió contínua per acció d’una reacció química ( cel·la electroquímica
), tensió que va decreixent a mesura que la pila es va consumint.
És anomenada també pila elèctrica, pila galvànica o pila voltaica Essencialment es compon d’un electròlit i dos elèctrodes positiu i negatiu, que constitueixen un parell voltaic a més, hi ha el despolaritzador La primitiva pila de Volta 1793 era formada per una sèrie de discs de coure i zinc disposats alternativament i entre els quals hi havia unes peces de cartó o drap amarades d’àcid sulfúric Aquesta pila presentava l’inconvenient de polaritzar-se, i per això les posteriors modificacions introduïdes donaren lloc a diversos tipus de piles en les quals hom disposava un…
cel·la electroquímica
Química
Dispositiu en el qual hom aconsegueix que s’efectuï una reacció química gràcies al forniment d’energia elèctrica (en el qual cas hom l’anomena cel·la electrolítica, i l’operació en conjunt rep el nom d’electròlisi) o en el qual, inversament, es produeix energia elèctrica a partir de l’energia alliberada per una reacció química que hi té lloc espontàniament (i és anomenat aleshores pila o cèl·lula voltaica).
Consisteix en un recipient que conté un o més electròlits units per ponts salins conductors o per parets poroses, amb dos elèctrodes immergits dins el líquid i connectats entre ells a través d’un circuit exterior En la cella té lloc, en tot cas, una reacció global d’oxidoreducció a l' ànode té lloc la semireacció d’oxidació, i al càtode , la de reducció Quan la cella funciona com a recinte d’una electròlisi, hom aplica una diferència de potencial als elèctrodes, amb la polaritat positiva a l’ànode i la negativa al càtode, per tal de proporcionar a aquest elèctrode els electrons necessaris per…
electricitat
Electrònica i informàtica
Part de la física que estudia l’electricitat.
Concepte i aplicacions de l’electricitat Hom considera que els fenòmens elèctrics són deguts a l’existència de les càrregues elèctriques , les partícules constitutives de la matèria L’explicació dels fenòmens elèctrics d’un cos radica, en definitiva, en l’estat dels seus àtoms Un àtom és en estat neutre, és a dir, no presenta activitat elèctrica, quan el nombre d’electrons càrrega negativa coincideix amb el nombre de protons càrrega positiva Experimentalment hom ha comprovat que hi ha dos tipus d’estat elèctric l’estat positiu, degut a un defecte d’electrons en els àtoms constitutius del cos…