Un viatge amb cotxe elèctric cap al món recarregable (I)
-
- Home
-
- 3 of 5
A molts us sorprendrà que l’any 1900 prop del 40% dels cotxes que es fabricaven als Estats Units eren elèctrics. Dels restants, un altre 40% era de propulsió per motor de vapor i el 20% era de combustió interna [2]. A partir de llavors i durant la primera dècada del segle XX el cotxe elèctric va viure la seva època daurada, que seria eclipsada a partir de la segona dècada amb els vehicles de combustió interna de combustibles fòssils. Les xarxes de carreteres milloraven i allargaven les distàncies que es podien recórrer, fet que anava apartant el vehicle elèctric, que tenia una autonomia molt més limitada, d’uns 50-100 km. Es descobrien grans reserves de petroli i el preu de la gasolina queia, i això també desmotivava la cerca d’alternatives. Les grans marques de l’automoció, com Ford, apostaven per la combustió interna i el cost d’aquests vehicles s’anava reduint empesos per la seva producció en massa. El vehicle elèctric, doncs, que havia d’incorporar costoses i pesades bateries, anava quedant arraconat fins a ser insignificant en el mercat.
A tall d’exemple, aquell 1900 els Estats Units van fabricar poc més de 4.000 automòbils. El 2020, en ple any de crisi, el món en va fabricar quasi 80 milions [3]. D’aquests, un 4,2% seria elèctric o híbrid [4, 5], un percentatge que s’està disparant amb vista a dominar el mercat de cara al 2025 [6]. Els motius del seu creixement serien ara els antagònics a la seva davallada d’aquells anys 10 del segle passat: evitar la dependència envers els combustibles fòssils i l’assoliment d’unes autonomies cada vegada més competitives.

Figura 1: A l’esquerra, l’inventor Thomas Edison amb un vehicle elèctric, l’any 1913 [6]. A la dreta, un vehicle Tesla model Y de l’any 2021.
L’exemple dels vehicles elèctrics és il·lustratiu de l’auge de les bateries que ja estem vivint avui dia. Per a la tecnologia, poca cosa hi ha més atractiva que dominar l’emmagatzemament d’energia per al seu futur consum en forma d’electricitat. Amb l’avenç de les bateries hem modificat els nostres hàbits de consum: mòbils, portàtils, altaveus, càmeres, drons, rellotges, auriculars, patinets, bicicletes, transport... i també hem pogut emmagatzemar els excedents d’energia de les fonts renovables, intermitents, per al seu consum a conveniència.
La bateria d’ió liti és la principal responsable d’aquest nou canvi de paradigma, de crear aquest “món recarregable” a què ens endinsem. Així va quedar reconegut amb el premi Nobel de química del proppassat 2019 per a J. B. Goodenough (EUA), M. S. Whittingham (EUA) i A. Yoshino (Japó): “han posat les bases d’una societat sense fils, sense combustibles fòssils, i representen un gran benefici per a la humanitat”, deia el comunicat de premsa [7].
Tant és així que, a mesura que en tenim més dependència, les virtuts de les bateries també esdevenen les pròpies mancances: la seva capacitat limitada d’emmagatzematge d’energia, la velocitat de càrrega, la vida útil... Les tenim arreu, però sabem com funcionen?
Dissecció d’una bateria d’ió liti
Les bateries d’ió liti són una elegant obra de disseny de la ciència de materials. Tots els seus components hi compleixen funcions molt ben delimitades per a l’èxit de la seva funcionalitat.
El liti és tot just el tercer element de la taula periòdica (figura 2), fet que el posiciona com l’element sòlid més lleuger que existeix. Comencem bé, la seva lleugeresa el fa ja de per si molt interessant. De fet, la seva densitat és la meitat de la de l’aigua i, per tant, sura. Val més no provar-ho, però! És un metall alcalí i és fortament electropositiu: li agrada molt desprendre’s del seu tercer electró que queda solitari en la seva segona capa d’electrons, de manera que queda ionitzat molt fàcilment. Això el fa un element molt reactiu –reacciona molt fàcilment amb l’aigua i l’aire– i no el trobem en estat pur a la natura.
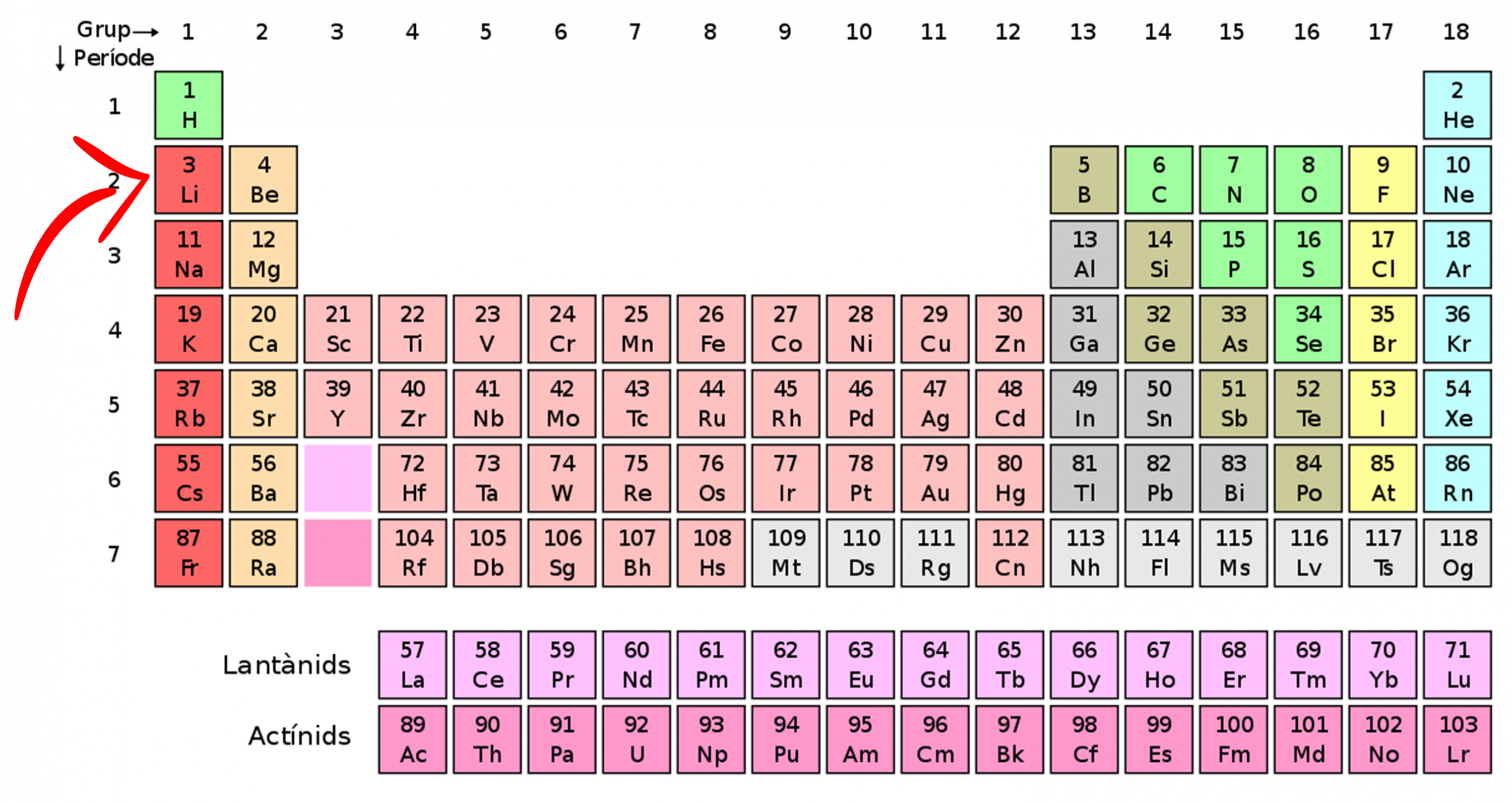
Figura 2. La taula periòdica dels elements [8]. El liti és el tercer element, tot just darrere l’hidrogen i l’heli. Només té 3 protons i 3 electrons i és estable amb 4 neutrons (92,5%) o 3 (7,5%).
Per evitar-ne aquesta perillositat, es busca l’estabilitat del liti incorporant-lo en òxids metàl·lics, normalment amb cobalt o níquel. Aquests òxids formen el que serà el càtode de la nostra bateria, el seu pol positiu.
Mentre carreguem la bateria (vegeu la figura 3), apliquem un voltatge que permet extreure els ions de liti i els seus electrons del càtode. Per un costat, els electrons passaran pel circuit elèctric i aniran a parar a l’ànode (pol negatiu), una estructura laminar de grafit que els acollirà. Paral·lelament, els ions de liti faran la ruta per la mateixa bateria fins a omplir la matriu amfitriona de grafit, en un procés que s’anomena intercalació. Aquest desplaçament dels ions té lloc a través de l’electròlit, el medi que omple la bateria i que, de manera interessant, permet la conducció d’aquests ions però no la d’electrons.
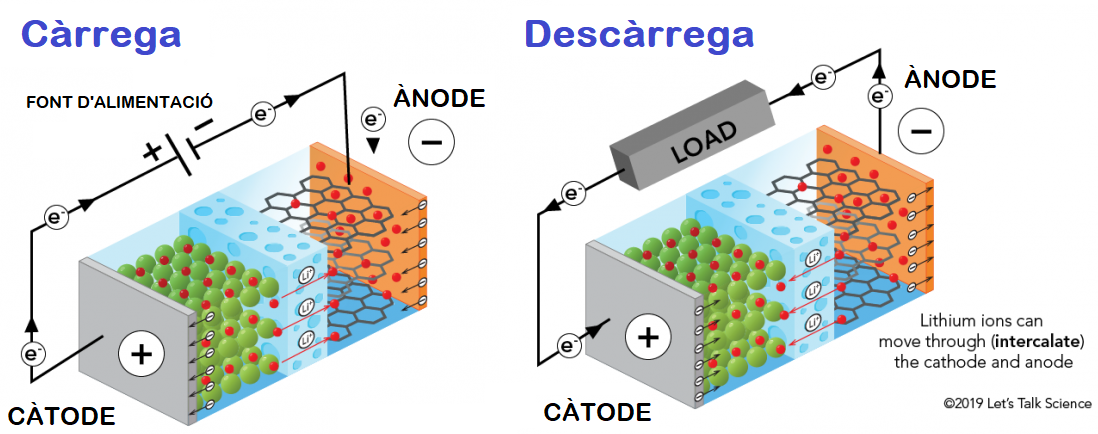
Figura 3. Representació adaptada de [10] d’un procés de càrrega (esquerra) i descàrrega (dreta) d’una bateria d’ió liti. Durant el procés de càrrega, els ions de liti i els electrons es desplacen cap a l’ànode, on hi ha les làmines de grafit que els emmagatzemen. Tan bon punt connectem la bateria a un circuit electrònic, aquesta es comença a descarregar amb el retorn dels ions i els electrons al càtode. Com que els electrons es veuen forçats a seguir un camí diferent, fora de la bateria, s’aconsegueix suplir un corrent elèctric al circuit desitjat.
Un cop l’ànode s’ha carregat dels ions i els electrons, aquest queda en un estat molt inestable. Els electrons i els ions de liti “volen” tornar al seu estat estable que troben en l’òxid de liti del càtode. Si s’hi obrís un camí directe cap al càtode, com per un simple contacte o la deterioració de l’electròlit, tindríem un curtcircuit que podria fins i tot causar l’explosió de la bateria. Per evitar-ho, les bateries incorporen una làmina entre l’ànode i el càtode, el separador, que garanteix que no es toquin i només permet el pas dels ions, tal com ens interessa.
Tan bon punt connectem la bateria a un circuit electrònic, els ions i els electrons revertiran el viatge i tornaran al càtode. Els electrons circularan ara per la càrrega que vulguem alimentar, suplint-la així del corrent elèctric que estem buscant sota un voltatge d’uns 3,6 V. I si volem més voltatge? Només haurem de connectar en sèrie més bateries. I si volem més intensitat elèctrica, o sigui, més flux d’electrons, sota el mateix voltatge? Haurem de connectar més bateries en paral·lel, fet que ens augmentaria la potència que estaríem suplint.
Reptes del moment
Actualment, les bateries d’ió liti poden repetir aquest cicle de càrrega i descàrrega fins a unes 500-1.000 vegades. L’envelliment i l’exposició a temperatures inadequades van deteriorant els components de les bateries, especialment de l’electròlit. No cal dir que hi ha molt d’interès per part de la indústria a anar engrandint aquest nombre de cicles fins a un mínim de 10.000, cosa que permetria un bon marge per a la seva futura vida útil.
Un altre paràmetre a maximitzar és l’energia que poden emmagatzemar per volum, la densitat d’energia volumètrica. El repte, però, no és fàcil. Una solució podria ser l’ús de silici en l’ànode, en comptes del carboni del grafit [11]. En rebre els ions de liti es formaria el Li15Si4, en comptes del LiC6. En altres paraules, un àtom de silici podria emmagatzemar quasi 4 ions de liti, mentre que en el cas del carboni es necessiten 6 àtoms per emmagatzemar un sol ió de liti. El problema, però, més enllà que la fabricació a gran escala no està resolta, és que en aquest procés l’ànode de silici triplica el seu volum: és perillós.
En el cas del grafit aquesta expansió és considerable, però molt menor, d’un 10%. Amb tot, tal com s’il·lustra a la figura 4, aquest continua essent un problema. Concentrar més energia emmagatzemada s’associa a menys estabilitat tèrmica de les bateries.
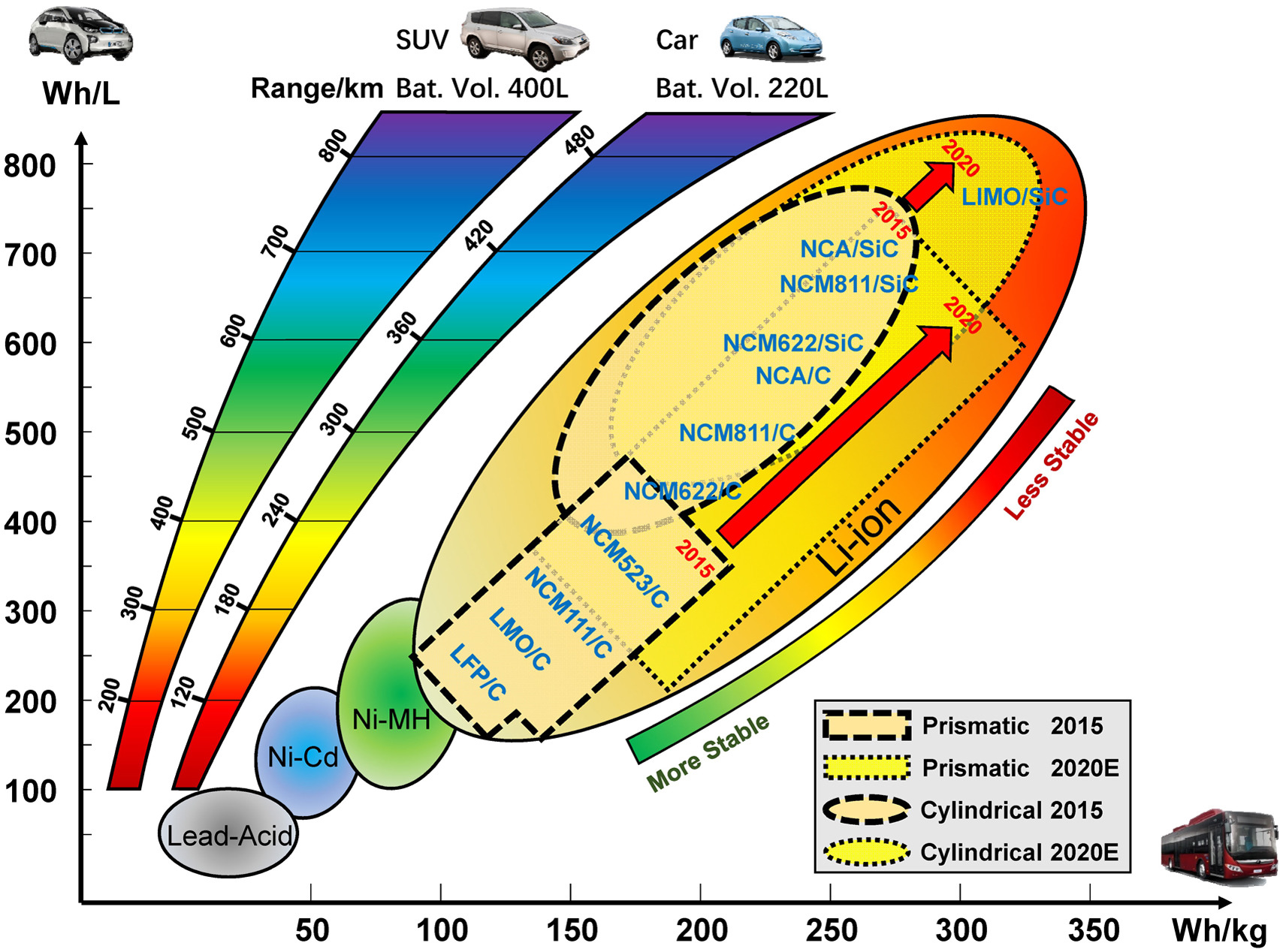
Figura 4. Mapa de diferents tipus de bateria en funció de la seva densitat d’energia que poden emmagatzemar, per unitat de volum (eix Y) i massa (eix X), extret de [12]. La franja grisa es refereix a les de plom i àcid, la blava al níquel-cadmi, la verda al níquel-hidrur metàl·lic, i la gran franja groguenca a les bateries d’ió liti, amb valors molt més competitius. En el cas de la bateria d’ió liti, es distingeix entre les geometries prismàtiques o cilíndriques que poden adoptar. Malauradament, a valors més alts de la densitat d’energia es comença a comprometre la seva estabilitat tèrmica i seguretat (zona més rogenca). Si doneu una ullada a la composició, veureu que aquestes incorporen silici a l’ànode (SiC). A la part esquerra del gràfic hi podem veure dues franges que indiquen els valors representatius que es necessitarien per assolir cada autonomia (en km) per a vehicles amb bateries de volums típics de 400 o 220 litres.
Un altre aspecte a millorar és el temps de càrrega. La càrrega implica, com hem vist, un escalfament i una expansió de l’ànode. Com més ràpida la puguem fer, més ràpida serà l’expansió i major l’escalfament, cosa que també en compromet la seguretat.
I com que en aquest bloc procuro parlar d’aplicacions del fred en la ciència dels materials, aquí ve el meu afegitó. L’estabilitat tèrmica de les bateries és un coll d’ampolla per al progrés de la seva funcionalitat. Aquesta és, de fet, una de les majors preocupacions de la indústria automobilística per a la millora de les prestacions dels nous models. Les grans marques, com Tesla, ho saben bé i estan implementant enginyosos mètodes de refredament que combaten el sobreescalfament de les seves bateries. Una inversió que val la pena: s’aconsegueixen, així, temps de càrrega més ràpids i el perllongament de la seva vida útil, ja que minimitzen una exposició a temperatures elevades que contribueix fortament a la seva degradació.
En sentirem a parlar
Sentim a parlar sovint de la revolució verda que representa l’entrada en massa dels “vehicles de zero emissions” a les nostres ciutats, però no tot són flors i violes. Aquestes afirmacions, massa simplistes, invisibilitzen l’impacte real del conjunt de la cadena d’energia que hi ha darrere. Ens és fàcil apreciar els avantatges del “món recarregable”, però potser no tant veure’n els costos mediambientals i socials que hi ha darrere i queden amagats.
I com que avaluar tot aquest impacte dona prou de si i mereix fer-ho amb tranquil·litat, en parlarem al proper article: Un viatge amb cotxe elèctric cap al món recarregable (II). A reveure!
Referències
- [1] Imatge de la portada: Getty Images.
- [2] Westbrook, M. H. The Electric Car: Development & Future of Battery, Hybrid & Fuel-Cell Cars (Institution of Engineering and Technology, 2001).
- [3] Statista, Estimated worldwide automobile production from 2000 to 2020.
- [4] International Energy Agency, Global EV Outlook 2020.
- [5] D. Carrington, "Global sales of electric cars accelerate fast in 2020 despite pandemic", The Guardian.
- [6] G. Parkinson, "The Osborne effect: Why new car sales will be all electric in six years", The Driven.
- [7] Imatge de https://americanhistory.si.edu/edison/ed_d22.htm
- [8] Press release: The Nobel Prize in Chemistry 2019.
- [9] Wikimedia Commons. https://commons.wikimedia.org/wiki/File:Taula_peri%C3%B2dica.svg
- [10] B. Chapman," How does a lithium-Ion battery work?"
- [11] Schneider, David. "Silicon anodes will give lithium-ion batteries a boost". IEEE Spectrum 56.1 (2018): 48-49.
- [12] Feng, Xuning, et al. "Thermal runaway mechanism of lithium ion battery for electric vehicles: A review". Energy Storage Materials 10 (2018): 246-267.