La consecució de grans avenços científics o l'establiment de nous paradigmes va sovint associat amb el desenvolupament de noves tecnologies, que permeten realitzar aproximacions noves a les preguntes que hom té plantejades. Per això els desenvolupaments procedimentals i tecnològics també van ocupar aquest 2015 un lloc destacat en les revistes científiques de referència.
Optogenètica

Fototeca.cat / toufikbobo / Fotolia.com
© Biblioteca de Gironella
Una d'aquestes noves tècniques és l'optogenètica. Descrita per primer cop l'any 2005, permet enregistrar i manipular l'activitat de circuits neuronals definits genèticament, i està revolucionant la neurociència. Per aquest motiu, la revista Nature la va destacar aquest any com una de les tècniques més importants de la dècada. Es defineix com la branca de la biotecnologia que combina l'òptica amb l'enginyeria genètica (d'aquesta combinació en deriva el nom) amb l'objectiu d'observar i controlar la funció de grups de cèl·lules que han estat marcades de manera específica amb gens concrets, mitjançant llum de determinades longituds d'ona, especialment en animals vius. En resum, es basa en la introducció, en el genoma de l'organisme o de les cèl·lules que es volen estudiar, de gens que codifiquen proteïnes híbrides que inclouen un fragment que s'estimula gairebé instantàniament (en menys de 50 mil·lèsimes de segon) quan és irradiada amb llum d'una determinada longitud d'ona, la qual cosa activa la funcionalitat de la resta de la proteïna, o bé, que de manera alternativa emet llum també en una determinada longitud d'ona quan la resta de la proteïna funciona espontàniament de manera fisiològica. Això permet fer dues aproximacions experimentals diferents.
D'una banda, l'ús de proteïnes que emeten fotons quan funcionen espontàniament de manera fisiològica permet fer un seguiment precís, en les cèl·lules individuals, de la seva activitat en animals vius, és a dir, tant en condicions normals com en qualsevol modificació experimental. En aquest sentit, per exemple, s'han realitzat estudis que han permès definir de manera molt precisa, en l'àmbit de neurones individuals concretes, quina és la xarxa neural implicada en l'emoció de la por, la qual es localitza en una zona del cervell anomenada amígdala, o de quina manera el consum de cocaïna afecta la funcionalitat de les neurones de l'anomenat nucli Accumbens, que està implicat en els processos mentals de recompensa i reforçament de la conducta, entre altres estudis amb importants implicacions biomèdiques i socials.
D'altra banda, utilitzar proteïnes que n'activen la funció de manera gairebé instantània quan són irradiades amb la longitud d'ona adequada permet activar a voluntat xarxes neuronals específiques amb independència de totes les altres. En aquest cas normalment es fan servir proteïnes que regulen el pas d'ions a través de la membrana de les neurones (canals d'ions), principalment del catió calci, atès que és la manera més habitual com es genera un impuls neuronal, però en aquest model experimental únicament el generen quan són irradiades amb llum de la longitud d'ona adequada. Això permet un control precís i instantani de la xarxa neural que es vol activar, la qual cosa permet correlacionar-la amb canvis fisiològics o conductuals. En aquest sentit, s'han induït comportaments conductuals específics en diversos models animals activant, per exemple, xarxes neurals dopaminèrgiques.
Segons els experts, la propera dècada es podran començar a desenvolupar els primers tractaments biomèdics basats en l'optogenètica. El 2015 es van fer els primers assaigs, concretament en el camp de la medicina regenerativa, per restaurar la funció muscular en models animals amb traumatismes que afecten el sistema nerviós perifèric, com el nervi ciàtic. L'ús d'aquesta tècnica permet activar de manera controlada l'inici de la seva activitat un cop les noves cèl·lules s'han integrat correctament en els circuits neurals preexistents, la qual cosa evita activacions aleatòries prèvies que poden dificultar el procés de maduració cel·lular. També s'ha començat a treballar en el control optogenètic de cèl·lules de la retina i dels circuits neurals implicats en el dolor, per tractar determinats tipus de ceguesa i de dolor crònic.
Ampliació del codi genètic
Una altra tecnologia nova, que en aquest cas permet incrementar exponencialment la diversitat de biomaterials per a usos biotecnològics, és l'ampliació experimental del codi genètic. Tots els éssers vius de la Terra comparteixen el mateix sistema de codificació genètica, el qual és format per quatre nucleòtids diferents: adenina, timina, guanina i citosina, que es representen amb les inicials A, T, G i C respectivament, i que en la doble hèlix que constitueix l'ADN s'aparellen sempre de la mateixa manera: A-T i C-G. El missatge genètic codificat en cada gen depèn de l'ordre concret d'aquestes molècules, i la seva descodificació, de l'anomenat codi genètic. Aquest codi també és universal, i a cada tres nucleòtids consecutius d'una de les dues cadenes de l'ADN hi fa correspondre un aminoàcid concret. Amb aquest llenguatge de quatre "lletres", el nombre d'aminoàcids que de manera natural poden formar part de les proteïnes es limita a vint, i la combinació d'aquests vint possibles aminoàcids en les proteïnes permet una gamma de funcions biològiques immensa, però no és completament il·limitada. D'altra banda, el fet que els nucleòtids de les dues cadenes s'emparellin sempre de manera precisa permet un mecanisme de còpia molt simple, atès que durant la replicació de l'ADN cadascuna de les dues cadenes serveix de motlle per a fabricar la complementària.
Per tal d'ampliar les possibilitats codificadores del codi genètic i, en conseqüència, de les funcions que poden realitzar les proteïnes que a partir d'aquí se sintetitzen, s'ha dissenyat un bacteri de l'espècie Escherichia coli, el material genètic del qual conté dos nucleòtids extra a més dels quatre naturals, anomenats d5SICS i dNAM, i que es representen amb les lletres X i Y respectivament. Aquests dos nucleòtids s'emparellen entre si en la doble hèlix de l'ADN, la qual cosa els confereix tota l'estabilitat funcional necessària i la capacitat de copiar-se sense cap ajuda durant el procés de replicació del material genètic. Aquests bacteris, a més, inclouen els mecanismes moleculars necessaris per a incorporar-los al medi de cultiu, la qual cosa permet, d'una banda, que es puguin reproduir per si mateixos, i, de l'altra, per seguretat, evita que puguin sobreviure fora de les condicions controlades del laboratori, atès que no els poden fabricar per si mateixos i fora del laboratori aquests nucleòtids sintètics no existeixen.
Amb aquests dos nucleòtids extra afegits al codi genètic, la possibilitat d'incorporar aminoàcids diferents a les proteïnes augmenta fins a més de 170. De moment, únicament s'ha afegit un sol parell de nucleòtids X i Y en un fragment controlat de material genètic d'E. coli, concretament en un plasmidi, i s'ha comprovat que el bacteri sobreviu i és capaç, en el medi adequat, de copiar aquest material genètic de manera correcta i de reproduir-se. Queda pendent encara modificar el codi genètic d'aquests organismes per a incorporar aminoàcids extra, però segons les previsions, aquesta tècnica permetrà ampliar exponencialment la gamma de productes biotecnològics, inclosos els fàrmacs, els nanomaterials, les vacunes, els antibiòtics, etc., a partir d'organismes bacterians semisintètics.
Exosomes
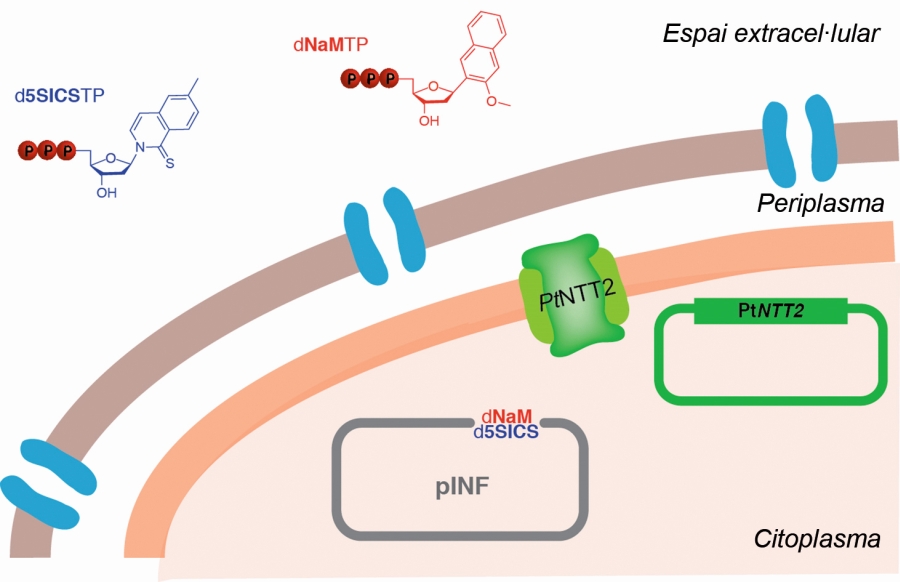
Enguany es va dissenyar un bacteri de l’espècie Escherichia coli, el material genètic del qual conté dos nucleòtids extra a més dels quatre naturals, anomenats d5SICS i dNAM
© Romesberg Lab / The Scripps Research Institute
Els exosomes són vesícules de 50 a 100 nanòmetres de diàmetre que les cèl·lules secreten de manera natural. Estan embolcallats per una membrana que conté proteïnes específiques, les quals són reconegudes per altres cèl·lules. Això permet que en arribar al seu destí es fusionin amb les cèl·lules diana, i d'aquesta manera puguin transportar substàncies de manera dirigida d'una cèl·lula a una altra. En conseqüència, és un mecanisme fisiològic de comunicació intercel·lular. Van ser descoberts fa trenta anys, i es va veure que en el seu interior transporten una gran varietat de proteïnes i de lípids. L'any 2013 es va observar que, a més, també transporten petites molècules d'àcid nucleic, concretament els anomenats ARNmi, la funció de les quals és regular la funció de gens concrets de manera dirigida mitjançant el fenomen genètic d'interferència mediada per ARN (ARNi). Això ha permès, d'una banda, començar a dissenyar assaigs diag-nòstics per determinades patologies, en què el potencial de comunicació d'aquests exosomes és especialment rellevant, com en molts tipus de càncer. En aquest sentit s'ha vist que algunes cèl·lules tumorals poden desinhibir els mecanismes de control del cicle cel·lular de les cèl·lules veïnes a través de l'ARNmi que transporten els exosomes que alliberen.
Per això, aquest 2015 també es van realitzar assaigs al laboratori per a sintetitzar exosomes artificialment. L'objectiu és utilitzar el seu gran potencial de transport i domiciliació selectiva per a subministrar fàrmacs que actuïn de manera dirigida en les cèl·lules on són necessaris. Això inclou molècules d'ARNmi que actuïn selectivament sobre el funcionament dels seus gens. Una de les aplicacions més directes que poden tenir és també en processos cancerosos, atès que poden actuar de manera exclusiva en les cèl·lules tumorals a través dels marcadors específics que tenen a la membrana, respectant la integritat de tots els altres teixits del cos.
Tècnica CRISP

Els xenotrasplantaments d’òrgans de porcs en humans podrien ser més efectius gràcies a l’ús de la tècnica CRISP
© Fototeca.cat / Simone van den Berg - Fotolia.com
Finalment, també va ser notícia destacada pel que fa a avenços tecnològics i biotecnològics amb rellevància general una nova optimització de la tècnica anomenada CRISP (o CRISP/Cas9), la qual ja va ser notícia l'any 2014. Aquesta optimització permet reescriure fragments de la seqüència de gens in vivo, incloent-hi gens humans, per corregir mutacions responsables de malalties genètiques. Enguany es van aïllar nous enzims que permeten fer aquests canvis de manera molt més simple, efectiva i precisa, la qual cosa probablement permetrà per primer cop fer-ne un ús biomèdic --de moment tots els assaigs amb cèl·lules humanes s'han realitzat en condicions de cultiu, al laboratori--. A més, també es va començar a treballar en una altra aplicació amb importants conseqüències mèdiques, optimitzar els xenotrasplantaments d'òrgans.
Els xenotrasplantaments són trasplantaments entre espècies diferents. En el cas de les persones, l'animal que per fisiologia i anatomia és més adequat és el porc. Tanmateix, a hores d'ara, el principal problema de trasplantar òrgans de porc a pacients humans és el fet que dins el seu genoma hi ha una munió de retrovirus silenciats. Els retrovirus són uns tipus de virus que es caracteritzen per tenir el material genètic format per ARN. Com a part del seu cicle biològic normal, la majoria fan una còpia de la informació que contenen en una molècula d'ADN i la integren al genoma de la cèl·lula infectada. Des de la perspectiva evolutiva, el genoma de totes les espècies és ple de restes d'aquests retrovirus, que romanen silenciosos i inactius per la mateixa maquinària genètica, de manera que passen completament desapercebuts i sense cap conseqüència. Tanmateix, s'ha vist que quan canvien d'espècie es poden activar, la qual cosa pot tenir greus conseqüències per al receptor. Aquest efecte s'ha observat que es produeix quan es posen en contacte cèl·lules de porc i humanes al laboratori, cosa que impossibilita aquests xenotrasplantaments.
En aquest context, l'any 2015 es va començar a utilitzar la tècnica CRISP per a canviar la seqüència dels retrovirus que estan integrats en el genoma dels porcs que es pretén utilitzar per a fer xenotrasplantaments, de manera que els resulti virtualment impossible activar-se un cop siguin trasplantats a un pacient humà. De moment, es va començar pels 62 retrovirus de porc que podrien infectar les cèl·lules dels ronyons humans, la qual cosa sembla que ha de permetre eventualment el trasplantament de ronyons de porc a persones que necessitin sessions de diàlisi per a sobreviure.
Premis Nobel i reparació de l'ADN
Enguany, el premi Nobel de química va ser concedit a Tomas Lindahl, Paul Modrich i Aziz Sancar pels seus estudis en relació amb els mecanismes de reparació de l'ADN. Concretament, van desentrellar els mecanismes moleculars que utilitzen les cèl·lules per a reparar els danys al seu ADN, la qual cosa ha permès entendre el paper fonamental que tenen en la fisiologia cel·lular, per evitar mutacions i dissenyar tractaments especialment dirigits a cèl·lules canceroses, atès que es caracteritzen precisament per acumular danys molt extensos en el seu material genètic. També s'han utilitzat per a desenvolupar productes protectors, com, per exemple, locions de protecció solar per a la pell. Es calcula que cada dia l'ADN d'una persona experimenta milers de canvis espontanis, a causa, en part, de radiacions ultraviolades, la presència de radicals lliures, entre els quals hi ha substàncies oxidants i de productes amb efectes carcinògens, els quals se sumen a una certa inestabilitat inherent a la mateixa molècula d'ADN cada vegada que es copia durant la reproducció cel·lular. En aquest context, Tomas Lindahl va demostrar, a la dècada de 1970, que l'ADN no és una molècula tan estable com s'havia pressuposat fins aleshores, i va descobrir el primer mecanisme de salvaguarda i reparació, anomenat reparació per escissió de bases. Aziz Sancar va identificar un segon mecanisme, anomenat reparació per escissió de nucleòtids, que és el més utilitzat per a protegir l'ADN dels danys causats per la radiació ultraviolada. Finalment, Paul Modrich va descobrir el mecanisme que permet a les cèl·lules revisar l'ADN a mesura que el va copiant, i corregir els errors que s'hi van produint, el qual s'anomena reparació de desaparellaments.