Històricament, bé que el mot havia estat utilitzat en un sentit similar des de més antic (Albert Magne), la noció d’afinitat (és a dir, d’'inclinació’ mútua de les substàncies que reaccionen) fou introduïda per tal d’explicar els fenòmens químics al s XVIII, i popularitzada especialment per Boerhaave. Per als químics de l’època, l’afinitat era la força desconeguda que provocava i mantenia la unió dels àtoms, i durant molts anys un gran esforç especulatiu fou fet per identificar-la. Primerament, seguint el suggeriment de Newton, hom considerà que era una manifestació més de les forces de gravitació. Més tard, després de les descobertes de Davy, Berzelius interpretà l’afinitat com el resultat d’atraccions i de repulsions elèctriques. Malgrat la veritat parcial que aquest darrer punt de vista contenida, fins al desenvolupament de la moderna mecànica quàntica, les forces que donen lloc a l' enllaç químic no han estat conegudes i explicades. En l’entremig, els químics renunciades provisiòriament a conèixer la natura de l’afinitat, però es proposaren de mesurar-la. Thomsen i Berthelot cregueren haver-ho aconseguit en afirmar que l’afinitat venia mesurada per la calor de reacció, i Berthelot (1867) enuncià el seu ‘principi’, segons el qual tota transformació que es produeix sense intervenció d’energia exterior dóna naixença a les substàncies la formació de les quals desprèn més calor. L’estudi de les reacciosn d’equilibri demostrà que el ‘principi’ de Berthelot era fals, i el problema no fou definitivament resolt fins que Van't Hoff demostrà, el 1883, que l’afinitat d’una reacció ve mesurada per la variació de l’energia lliure de Gibbs, a temperatura i a pressió constants. En notació moderna, l’afinitat d’una reacció ve donada per la fórmula
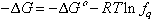
on Δ G és la variació d’energia lliure de Gibbs, Δ G ° la diferència entre potencials químics dels productes finals de la reacció i els dels productes inicials, tots ells en llurs estats de referència, i f q el quocient dels productes de les fugacitats (o activitats) dels productes finals de la reacció, pel producte de de les fugacitats (o activitats) dels productes inicials. Quan el sistema està en equilibri Δ G =0 i Δ G °=- RT ln K . K essent la cosntant d’equilibri definida per la llei d'acció de massa. Per tant, -Δ G = RT (ln f q ). Perquè una reacció tingui lloc espontàniament cal que l’afinitat sigui positiva, és a dir, que l’energia lliure de Gibbs disminueixi, i, per tant, cal que K /f q > 0. L’afinintat serà més elevada com més gran serà aquest quocient, és a dir, com més lluny estarà el sistema de les condicions d’equilibri.