Origen i propietats
És un dels metalls de la família dels actínids i és l’element més pesant d’ocurrència natural. Tot i haver estat emprat en l’antiguitat per a la preparació de vidre groc, N.H. Klaproth el descobrí com a element, i l’identificà com a component de la pechblenda (uraninita) l’any 1789. La seva preparació en forma pura fou feta per Peligot, que l’obtingué per reducció del clorur (UCl3) amb potassi l’any 1841. Té l’interès històric d’ésser l’element en el qual Becquerel descobrí la radioactivitat natural, l’any 1896. L’urani és àmpliament difós a la natura, i constitueix un 5 x 10-3% del pes de l’escorça terrestre, però són escassos els dipòsits en què es troba en forma concentrada. Els seus minerals més importants són la uraninita (UO2) i, en menys extensió, la coffinita (USiO4), la brannerita i la carnotita. L’urani natural és constituït per una mescla de tres isòtops, amb masses 238 (99,2830%), 235 (0,7110%) i 234 (0,0054%), tots tres radioactius. El 238U, amb una vida mitjana de 4,21 × 109 anys, és el punt de partida de la sèrie de desintegració radioactiva (4n+2), i el 235U, amb una vida mitjana de 7,1 × 108 anys, és el punt de partida de la sèrie (4n+3), mentre que el 234U, amb una vida mitjana de 2,47 × 105 anys, es forma a partir del 238U mitjançant emissió α. En són coneguts, a més, onze radioisòtops artificials. Tant l’isòtop 235U com el 238U i el 233U, format a partir del tori, són importants en la producció d’energia d’origen nuclear. L’obtenció del metall és complicada, i implica, generalment, una fase de concentració de la mena, al llarg de la qual hom recorre a tècniques de precipitació, extracció amb dissolvents, intercanvi iònic, electròlits o combinacions d’aquestes. La mena concentrada i purificada es transforma en uranat amònic, (NH4)2UO4, o en el triòxid d’urani, UO3, els quals es redueixen a UO2, que es converteix en el tetrafluorur, UF4, i aquest es redueix finalment amb magnesi de puresa elevada. Alternativament, hom el pot obtenir per reducció dels òxids amb calci o alumini, o per electròlisi de diversos halogenurs en el si de sals alcalines foses. L’urani destinat a la producció d’energia nuclear ha d’ésser totalment lliure d’elements amb secció de captura neutrònica gran, com ara bor o cadmi. L’urani metàl·lic pot existir en tres varietats cristal·lines: α, β i γ, amb temperatures de transició de 667°C i 772°C. La forma α, ròmbica, estable a baixa temperatura, presenta anomalies dilatomètriques molt intenses, raó per la qual l’urani destinat a combustible nuclear ha d’ésser emprat en forma de solucions sòlides (aliatge amb molibdè o crom), que en garanteixin l’estabilitat dimensional. D’altra banda, l’urani gaudeix d’excel·lents propietats mecàniques. És de color blanc d’argent, molt dens, dúctil i mal·leable. S’altera en l’aire per oxidació superficial i, en estat de divisió fina, és pirofòric. És, en general, un element reactiu, i es combina directament amb hidrogen, oxigen, sofre, halògens i d’altres no-metalls. Gaudeix de propietats reductores, i desplaça nombrosos metalls de llurs sals. Es dissol en els àcids minerals, i és inert enfront dels àlcalis. Forma composts, en els quals actua amb les valències 3, 4, 5 i 6, a més de diversos composts de natura semimetàl·lica. Els estats 2+, 3+ i 5+ són poc estables, mentre que el 4+ i el 6+ són els més importants i els més ben coneguts. D’entre els composts de l’urani (III) cal destacar l’hidrur, UH3, d’una gran estabilitat tèrmica, que és emprat en la preparació d’altres composts de l’element. Quant a l’estat 4+, són importants el diòxid, UO2, que presenta sovint desviacions estequiomètriques notables per inserció d’oxigen, i els halogenurs, UX4, útils per a la preparació del metall. Pel que fa als composts de l’estat 6+, és important l’hexafluorur, UF6, volàtil, que ha estat emprat en l’enriquiment del 235U mitjançant difusió gasosa, i l’òxid d’urani (VI), UO3, que s’hidrolitza en l’aigua i dona lloc, en medi bàsic, als uranats. Quant a la química aquosa de l’element, és important la formació d’oxocations (uranil). L’aplicació més important de l’urani és la producció energètica. Per a aquest ús, tant pot emprar-se urani enriquit en l’isòtop 235, directament físsil, com, en els reactors regeneradors, l’urani natural, gràcies a la transformació de l’isòtop 238 en el 239Pu (plutoni), el qual ja és físsil:
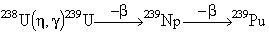
D’altra banda, el 233U, produït per irradiació amb neutrons del tori natural, és també útil com a combustible nuclear. L’urani i els seus composts són elevadament tòxics, tant des del punt de vista químic com radiològic.
La producció mundial d’urani

Mina d’urani Ranger (Territori del Nord, Austràlia)
Geomartin (Creative Commons)
La producció mundial d’urani fou, el 1973, de 19.480 t, cosa que representà un gran augment amb relació a les xifres anteriors a la Segona Guerra Mundial (500 t), a conseqüència de la seva conversió com a primera matèria essencial per a la producció d’energia nuclear. El 1997 la producció mundial augmentà fins a arribar a 36.734 t i el 2012, a 58.344 t. Aquest darrer any, els principals Països productors eren el Kazakhstan (21.317 t), Canadà (8.999) i Austràlia (6.991).
Propietats físiques de l’urani
| nombre atòmic | 92 |
| pes atòmic | 238,03 |
| estructura electrònica | [Rn] 5f36d17s2 |
| estats d’oxidació | +3, +4, +5, +6 |
| densitat | 19,07 g/ml |
| punt de fusió | 1 132ºC |
| punt d’ebullició | 3 818ºC |
| radi iònic (U+4) | 0,97 Å |
| conductivitat tèrmica (a 25ºC) | 0,275 W/cm∙K |
