Gas incolor d’olor etèria quan és pur (obtingut a partir del carbur de calci i no purificat té la desagradable olor característica de la fosfina), tòxic només a concentracions molt elevades (20% o més). Molt inflamable, crema amb flama molt brillant i fuliginosa de temperatura molt alta (amb oxigen ateny més de 3 000 C); i dóna amb l’aire mescles molt explosives. Altrament endotèrmic, és termodinàmicament inestable a la temperatura ambient i pot explotar d’una manera espontània quan hom el comprimeix a més de dues atmosferes. Lleugerament soluble en aigua, és bastant soluble en àcid acètic glacial, en alcohol, en benzè i, sobretot, en acetona. L’acetilè fou descobert per Davy el 1836, però el seu estudi científic data de la síntesi i els treballs efectuats per Berthelot cap al 1860. Industrialment és obtingut per acció de l’aigua sobre el carbur de calci o per piròlisi a alta temperatura (craqueig) d’hidrocarburs parafínics lleugers tals com el metà. El primer procediment es basa en al reacció exotèrmica
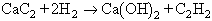
i és emprat tant en les antigues instal·lacions domèstiques (amb petits generadors, àdhuc portàtils) com en plantes industrials molt importants (amb grans generadors d’alimentació automàtica, que donen una producció regular de gas). El punt essencial és d’evitar temperatures i pressions altes, que podrien donar lloc a explosions, i els aparells són tals que hom treballa sempre per sota de 150 C i a una pressió absoluta inferior a 2 atm. A més de l’exotermicitat, cal tenir en compte el considerable augment de volum (1 kg de carbur dóna aproximadament 300 litres de gas i el volum d’hidròxid de calci format és unes 2,5 vegades el del carbur). Els generadors industrials més utilitzats són generadors ‘secs’ (que donen calç apagada gairebé seca), en els quals l’aigua arriba sobre el carbur pes per pes, amb agitació mecànica de manera que garanteixi que el carbur és utilitzat totalment i que no hi ha elevacions locals de temperatura. La puresa de l’acetilè obtingut depèn de la quantitat del coc i de la calç utilitzats per a fabricar el carbur. En general, l’acetilè conté fosfina, sulfur de divinil, amoníac i petites quantitats d’altres compostos. La purificació és efectuada amb oxidants, especialment amb aigua i clor. El craqueig tèrmic dels hidrocarburs és basat en el fet que per sobre de 1 330 C l’acetilè és més estable que qualsevol altre hidrocarbur. No obstant això, àdhuc a aquestes temperatures, és menys estable que els elements. Cal, doncs, aprofitar el fet que les reaccions de piròlisi, per exemple
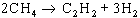
fortament endotèrmiques, són més ràpides que la descomposició. L’objectiu és, doncs, d’assolir l’equilibri com més aviat millor i de trempar tot seguit la barreja a baixa temperatura. Els temps de reacció són de l’ordre dels mil·lisegons. Els procediments es classifiquen en tres grups segons el mètode utilitzat per a fornir l’energia tèrmica: procediments per descàrrega elèctrica (procediments Huels, arcs elèctrics d’un metre de llarg en un forn de ferro); procediments per forn de regeneració (procediments Wulff, energia fornida per intercanvi amb refractaris sòlids en cicle alternat); procediments per combustió parcial (procediments Schsse-BASF i Hoechst, la combustió d’aproximadament un terç de l’hidrocarbur porta la resta de la temperatura de craqueig i forneix l’energia necessària). En tots els casos, l’acetilè s’ha de separar dels altres productes de la reacció, cosa que és efectuada amb dissolvents selectius. Un dels més utilitzats és la dimetilformamida . La comparació entre els dos grans mètodes de preparació de l’acetilè sembla ésser favorable des del punt de vista econòmic, a la piròlisi d’hidrocarburs. El consum d’energia hi és netament més baix i els procediments de piròlisi són encara susceptibles de perfeccionament i continuen donant lloc a una activa recerca. La major part de l’acetilè és utilitzat en el lloc mateix on és obtingut. Si cal transportar-lo, el perill d’exposició exclou de fer-ho comprimint-lo en cilindres metàl·lics, tal com hom fa amb els altres gasos. El transport és efectuat tanmateix en els dits cilindres, però en forma d’una solució acetònica que impregna una massa porosa adequada, i la pressió no ha d’ultrapassar 15 atm. A 12 atm i a 15 C la solubilitat de l’acetilè en l’acetona ateny 300 volums. Les propietats químiques de l’acetilè són les generals dels hidrocarburs de la sèrie acetilènica i més especialment les dels acetilènics terminals. Així, per exemple, els hidrògens de l’acetilè poden substituir-se per metalls amb formació d' acetilurs . (Els acetilurs de coure i de plata són explosius, cosa que fa que calgui proscriure aquests dos metalls en els aparells industrials en contacte amb el gas). L’acetilè dóna lloc, no obstant això, a nombroses altres reaccions que li són específiques, o que han estat especialment estudiades en el seu cas particular, i aquesta molt extensa branca de la química orgànica ha estat desenvolupada sobretot gràcies als treballs de Reppe i a la seva descoberta de catalitzadors adequats. Les reaccions esmentades poden classificar-se en quatre grans grups: vinilacions (reaccions amb conservació del triple enllaç), civilitzacions (combinacions de l’acetilè amb òxid de carboni). Alguns exemples típics són els següents : primer, la vinilació de la pirrolidona N-vinilpirrolidona . Segon, l’etinilació del formaldehid, que dóna el 2-butin-1,4-diol (primera matèria possible per a la fabricació del butadiè):

Tercer, la ciclització en ciclooctatetraè. Quart, la carbonilació amb formació d’hidroquinona:
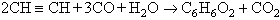
Les aplicacions industrials de l’acetilè comprenen les aplicacions directes i les seves aplicacions com a primera matèria per a la síntesi orgànica. Les aplicacions directes depenen de les propietats de la flama acetilènica i són: la soldadura i el tall dels metalls i la fabricació de robins sintètics amb el bufador oxiacetilènic; l’enllumenat a l’acetilè, molt generalitzat en una certa època i utilitzat encara en llocs isolats. Com a primera matèria bàsica per a la indústria orgànica de síntesi, l’acetilè tingué el seu apogeu cap al 1930. Des d’aleshores l’etilè l’ha substituït progressivament en moltes aplicacions, però, així i tot, hom no el pot considerar de cap manera totalment suplantat. No solament té el seu domini propi, on és per ara insubstituïble, sinó que àdhuc en els altres casos subsisteixen moltes antigues instal.lacions i, més encara, continuen essent muntats enormes forns de carbur, allí on l’energia elèctrica és barata, i en els altres llocs el craqueig del metà permet d’obtenir-lo a molt bon preu. Els principals productes obtinguts a partir de l’acetilè són actualment: l' acrilonitril , el clorur de vinil i el diclorur de vinilidè ,l' acetat de vinil , el cloroprè , els acrilats , el percloroetilè , el tricloroetilè , el negre d’acetilè , els diversos composts que deriven de l’anomenada química de Reppe i, en fi, totes les nombroses substàncies obtingudes a partir de les esmentades. Respecte a l' acetaldehid , bé que als estats on la indústria petroquímica és més desenvolupada (en particular als Estat Units) no es fabrica ja acetaldehid a partir de l’acetilè, en molts d’altres l’acetaldehid i tots els composts que en deriven continuen integralment provenint-ne.
