Present en el vinagre, al qual confereix les seves propietats àcides, és un dels més simples, el més antigament conegut i tècnicament el més important de tots els àcids orgànics. Les seves propietats físiques es detallen en el quadre. És miscible amb l’aigua, l’alcohol i l’èter i és insoluble en el sulfur de carboni. Com l’aigua, es contrau lleugerament en congelar-se. És un excel·lent dissolvent per a moltes substàncies orgàniques i dissol també el fòsfor i el sofre. Pur o en solució concentrada (del 50% o més) és molt corrosiu per als teixits i pot causar serioses cremades. Són perillosos també els seus vapors i la ventilació és necessària a partir de 10 ppm a l’atmosfera. A concentració no corrosiva pràcticament no és tòxic. Com a àcid és un àcid feble (constant d’acidesa K A = 1,75x10-5 a 25°C) i les seves propietats són les generals dels àcids carboxílics. Les seves sals i èsters s’anomenen acetats. Durant molts anys fou obtingut com es prepara el vinagre, és a dir, per oxidació de l’etanol diluït (8-10%) mitjançant l'Acetobacter aceti.
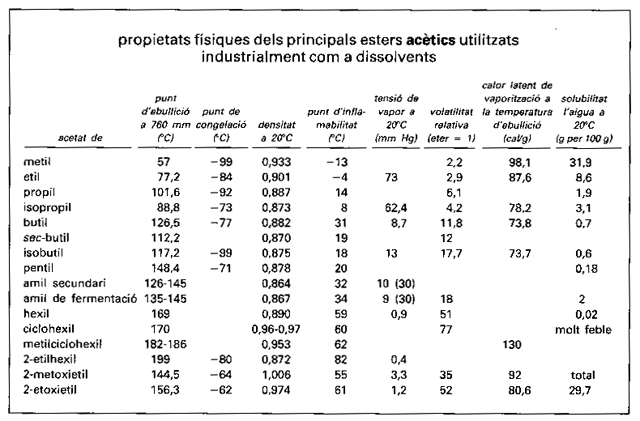
Propietats físiques dels principals esters acètics
©
