Estructura i síntesi de la penicil·lina
La penicil·lina fou aïllada per primera vegada el 1929 per Alexander Fleming, que l’obtingué del filtrat del cultiu del fong Penicillium notatum. Fleming trobà que la penicil·lina inhibia, in vitro, el creixement d’un cert nombre de bacteris patògens i que presentava baixa toxicitat per als animals. La seva química fou àmpliament estudiada durant la Segona Guerra Mundial a Anglaterra i als EUA, i posà de manifest que les penicil·lines aïllades en ambdós països diferien en la natura d’una cadena lateral unida a un nucli característic, i foren anomenades F i G. L’anàlisi estructural per degradació química i raigs X demostrà que les penicil·lines presenten l’estructura
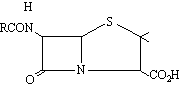
que conté un nucli condensat de β-lactam i tiazolidina i en la qual RCO és una cadena lateral variable, la natura de la qual depèn dels precursors presents en el medi en què el fong és cultivat. Són composts sensibles als àcids, essent la penicil·lina V la més estable a aquestes condicions, raó per la qual pot ésser subministrada per via oral. D’altra banda, les bases les inactiven mitjançant l’atac sobre l’anell de β-lactam. Des del punt de vista biosintètic, la penicil·lina prové de l’àcid 6-aminopenicil·línic,
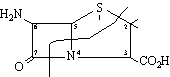
els precursors del qual són la L-cisteïna i la L-valina. Aquest darrer àcid és inactiu, raó per la qual els bacteris que posseeixen l’enzim penicil·linasa són resistents a l’acció de la penicil·lina, puix que la hidrolitzen per a donar l’àcid penicil·línic esmentat. Aquest fet ha estat aprofitat per a l’obtenció de penicil·lines semisintètiques, procedint a l’acilació de l’amina amb àcids, de manera que l’amida formada resisteixi la hidròlisi enzimàtica, com és el cas de la meticil·lina, de l’oxacil·lina i de la cloxacil·lina.
La primera síntesi efectiva de les penicil·lines, concretament de la V, fou aconseguida el 1957 per J.C. Sheehan. Amb tot, els processos d’obtenció de penicil·lina per síntesi total no són competitius amb els semisintètics, els quals inclouen fermentacions amb P.chrisogenum i eliminació enzimàtica de la cadena lateral. L’acció bactericida de les penicil·lines radica en llur interferència en la construcció de la paret cel·lular dels bacteris. La penicil·lina G, la més àmpliament emprada en medicina, és efectiva davant els bacteris grampositius, però inactiva enfront dels Staphylococcus aureus, els quals produeixen penicil·linasa. Aquest problema fou resolt amb la introducció de les penicil·lines semisintètiques. D’altra banda, l’ampicil·lina és activa enfront d’alguns bacteris gramnegatius. Les penicil·lines semisintètiques afegeixen a l’activitat clàssica contra bacteris grampositius de les penicil·lines naturals soques de bacteris Haemophilus i enterobacteris. Hi mostren resistència els estafilococs productors de penicil·linasa. Les més emprades són l’ampicil·lina i l’amoxicil·lina, ambdues absorbibles per via oral, per bé que l’amoxicil·lina s’absorbeix millor i permet l’addició a la seva molècula d’un inhibidor de les β-lactamases (enzims que hidrolitzen l’anell β-lactàmic de les penicil·lines), l’àcid clavulànic, que amplia l’espectre d’acció de l’amoxicil·lina a soques de bacteris resistents per ser formadors de β-lactamases. Cal tenir en compte que les penicil·lines naturals d’espectre limitat tenen una acció més activa davant dels bacteris grampositius. Les carboxipenicil·lines (carbenicil·lina, ticarcil·lina) i les ureidopenicil·lines (azlocil·lina, mezlocil·lina) són antibiòtics que amplien el seu espectre contra bacteris gramnegatius, però el minven contra els grampositius. Són gairebé antibiòtics d’ús exclusiu hospitalari i són actius contra infeccions produïdes per pseudomones, que són bacteris resistents a altres antibiòtics. Les penicil·lines isoxazòliques són resistents a la penicil·linasa. Només estan indicades en les infeccions produïdes per estafilococs. La més usada és la cloxacil·lina, de primera elecció en el tractament empíric de les infeccions cutànies. La penicil·lina pot produir sensibilització anafilàctica i donar lloc a reaccions greus.
Diferents penicil·lines
| nom químic | nom comercial | R | origen |
|---|---|---|---|
| pent-2-enilpenicil·lina | penicil·lina F | -CH=CH-C2H5 | natural |
| benzilpenicil·lina | penicil·lina G | -CH2C6H5 | natural |
| p-hidroxibenzilpenicil·lina | penicil·lina X | -CH2C6H4OH | natural |
| n-heptilpenicil·lina | penicil·lina K | -(CH2)6-CH3 | natural |
| n-pentilpenicil·lina | penicil·lina F | -(CH2)4-CH3 | natural |
| fenoximpetilpenicil·lina | penicil·lina V | CH2OC6H5 | natural |
| meticil·lina | -2,6-dimetoxifenil | semisintètica | |
| oxacil·lina | -5-metil-3-fenilisoxazole | semisintètica | |
| cloxacil·lina | -5-metil-3-O-clorofenilisoxazole | semisintètica | |
| ampicil·lina | D-α-aminobenzil | semisintètica | |
| carbencil·lina | -ɑ-hidroxibenzil | semisintètica |