Resultats de la cerca
Es mostren 25 resultats
hemoglobina
Bioquímica
Cadascuna de les ferroproteïnes, trobades en els eritròcits madurs de la sang dels vertebrats, que contenen el grup hem i actuen com a transportadores d’oxigen molecular.
L’hemoglobina és una de les proteïnes més ben conegudes quant a l’estructura i a la funció L’estructura tridimensional fou establerta per MFFerutz mitjançant els seus estudis per difracció de raigs X, entre el 1937 i el 1959, a Cambridge Una molècula d’hemoglobina és formada per dues parelles de subunitats proteiques idèntiques, disposades l’una vers l’altra com els vèrtexs d’un tetràedre Les dues cadenes α tenen cadascuna 141 residus d’aminoàcid, i les β en tenen 146 Cadascuna de les quatre cadenes conté, unida per forces no covalents, un grup hemo , l’ió Fe + + del…
carboxihemoglobina
Bioquímica
Derivat de l’hemoglobina que resulta de la combinació d’aquesta amb monòxid de carboni.
Per efecte de tal combinació l’hemoglobina perd la capacitat de transportar oxigen, puix que la unió entre el CO i el ferro de la molècula és més forta que la del ferro amb l’oxigen La carboxihemoglobina es produeix en les intoxicacions d’òxid de carboni, pel fet que aquest, per la seva gran avidesa per l’hemoglobina, pot desplaçar l’oxigen de la seva combinació oxihemoglobínica
transport de l’oxigen
Bioquímica
Funció principal de l’hemoglobina continguda en els eritròcits de la sang, des dels pulmons als teixits; un gram d’hemoglobina pot dur 1,36 cm3 d’oxigen.
Un eritròcit humà recorre en un mes unes 100 000 vegades el circuit sanguini complet i transporta al mateix temps unes 250 vegades el seu pes en oxigen Capacitat de transport de l'oxigen en la sang humana eritròcits milions % hemoglobina capacitat de O 2 en volum % nadons 5,0 17 28 nens de dos anys 4,3 12 16 homes adults 5,4 16 21 dones adultes 4,8 14 19
proteïnes homòlogues
Alimentació
Bioquímica
Proteïnes amb una estructura primària molt semblant.
Gairebé sempre tenen una funció biològica similar en una mateixa espècie, com la tripsina i la quimotripsina, les cadenes αi βde l’hemoglobina, o bé en espècies diferents, com les cadenes αde l’hemoglobina en els mamífers i la ferredoxina en els bacteris i les algues blau verdes
hem
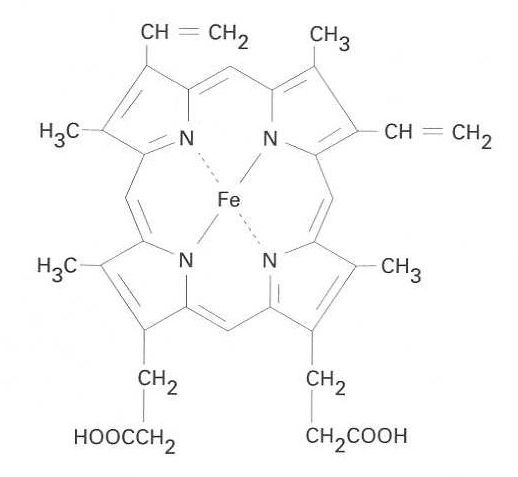
Hem
©
Bioquímica
Complex quelat de la protoporfirina amb l’ió ferrós que actua de grup prostètic de certes ferroproteïnes.
És present en l’hemoglobina i en la mioglobina, i és també el grup prostètic dels enzims peroxidases, catalases i citocroms En el cas dels citocroms, el ferro experimenta canvis reversibles de valència FeII →FeIII La forma que conté FeIII és anomenada sovint hemina Dóna el color vermell a l’hemoglobina i es combina amb l’oxigen per al transport sense alteracions de valència
histidina
Bioquímica
Aminoàcid heterocíclic bàsic, essencial per a molts animals però probablement no per a l’home.
És un precursor de la histamina, i hom el troba abundantment dins la molècula d’hemoglobina
Max Ferdinand Perutz
Bioquímica
Bioquímic austríac, naturalitzat britànic.
Investigador i professor a Cambridge des del 1940, rebé el premi Nobel de química l’any 1962, juntament amb JCKendrew, pel descobriment de l’estructura tridimensional de l’hemoglobina i de la mioglobina, gràcies al perfeccionament de la tècnica de difracció dels raigs X
protoporfirina
Bioquímica
La més abundant de totes les porfirines, formada per una molècula de porfina substituïda per 4 grups metil, 2 grups vinil i 2 grups d’àcid propiònic.
N'hi ha 15 isòmers possibles, el més abundant dels quals és la protoporfirina IX Es troba a l’hemoglobina, a la mioglobina i a la majoria de citocroms Forma quelats amb ions metàllics ferro, magnesi, zinc, níquel, cobalt i coure El complex amb ferro II és anomenat protohem o simplement hem, i el format amb ferroIII, hemina o hematina