Resultats de la cerca
Es mostren 7 resultats
fugacitat
Física
Química
Funció termodinàmica que substitueix la pressió parcial en les equacions que tracten de descriure el comportament dels gasos reals.
Si G 1 i G 2 són les energies lliures normals d’un gas a dues pressions p 1 i p 2 , les fugacitats f 1 i f 2 del gas a aquestes pressions són definides de forma que es compleixi l’equació G 2 — G 1 = nRT ln f 2 / f 1 Comparant aquesta equació amb l’equació dels gasos ideals G 2 — G 1 = nRT ln p 2 / p 1 , hom veu que, per al comportament ideal, la fugacitat és proporcional a la pressió contràriament, per al comportament no ideal la fugacitat no coincideix amb la pressió corresponent La fugacitat pot ésser determinada per l’equació RT ln f/p = v — RT /p…
equació de Van’t Hoff
Química
Equació que determina la variació de la constant d’equilibri químic K en funció de la temperatura.
Segons l’expressió ∂ln K /∂ T p = Δ H 0 / RT 2 , Δ H 0 essent la variació d’entalpia en la reacció en condicions normals, R la constant dels gasos i T la temperatura absoluta
coeficient osmòtic
Física
Química
Coeficient introduït per Bjerrum, que inclou tots els factors que expressen la desviació del comportament d’una solució respecte del comportament ideal.
D’aquesta forma, per un component i d’una barreja, el potencial químic s’expressa per μ i =μ o i + g i RT ln x i on g i és el coeficient osmòtic i x i és la fracció molar del solut en la dissolució
energia d’activació
Química
En cinètica química, la quantitat E que apareix en l’equació empírica d’Arrhenius
.
L’equació dóna la variació de la constant de velocitat k d’una reacció en funció de la temperatura absoluta T L’energia d’activació E suposada independent de T és interpretada com l’energia que han d’assolir conjuntament les molècules dels reactants perquè la reacció tingui lloc, i el fenomen de la catàlisi és interpretat com un abaixament de l’energia d’activació a causa de la presència del catalitzador Independentment de tota hipòtesi, el valor d' E és calculable a partir de dades experimentals amb resultats prou coherents perquè l’equació d’Arrhenius tingui validesa pràctica En efecte,…
elèctrode de quinhidrona
Química
Elèctrode basat en el sistema redox i constituït per la p-benzoquinona i la hidroquinona: .
Hom prepara l’elèctrode dissolent una quantitat de quinhidrona en el sistema a estudiar En aquestes condicions, el potencial adquirit per un elèctrode inatacable submergit en la dissolució és donat per l’expressió E = E° - RT/F ln a H + , sempre que hom pugui suposar que les activitats de la p- benzoquinona i de la hidroquinona són idèntiques L’elèctrode de quinhidrona es comporta aleshores com un elèctrode d’hidrogen, amb un valor de E° = -0,6994 + 0,00074 t , on t és una temperatura entre 0 i 37°C Com a conseqüència, l’elèctrode de quinhidrona troba l’aplicació en la…
afinitat
Química
Tendència d’una mescla de substàncies a reaccionar químicament, que ve mesurada per la disminució de l’energia lliure de Gibbs que la reacció, a temperatura i a pressió constants, provoca.
Històricament, bé que el mot havia estat utilitzat en un sentit similar des de més antic Albert Magne, la noció d’afinitat és a dir, d’‘inclinació’ mútua de les substàncies que reaccionen fou introduïda per tal d’explicar els fenòmens químics al segle XVIII, i popularitzada especialment per Boerhaave Per als químics de l’època, l’afinitat era la força desconeguda que provocava i mantenia la unió dels àtoms, i durant molts anys un gran esforç especulatiu fou fet per identificar-la Primerament, seguint el suggeriment de Newton, hom considerà que era una manifestació més de les…
nitrogen
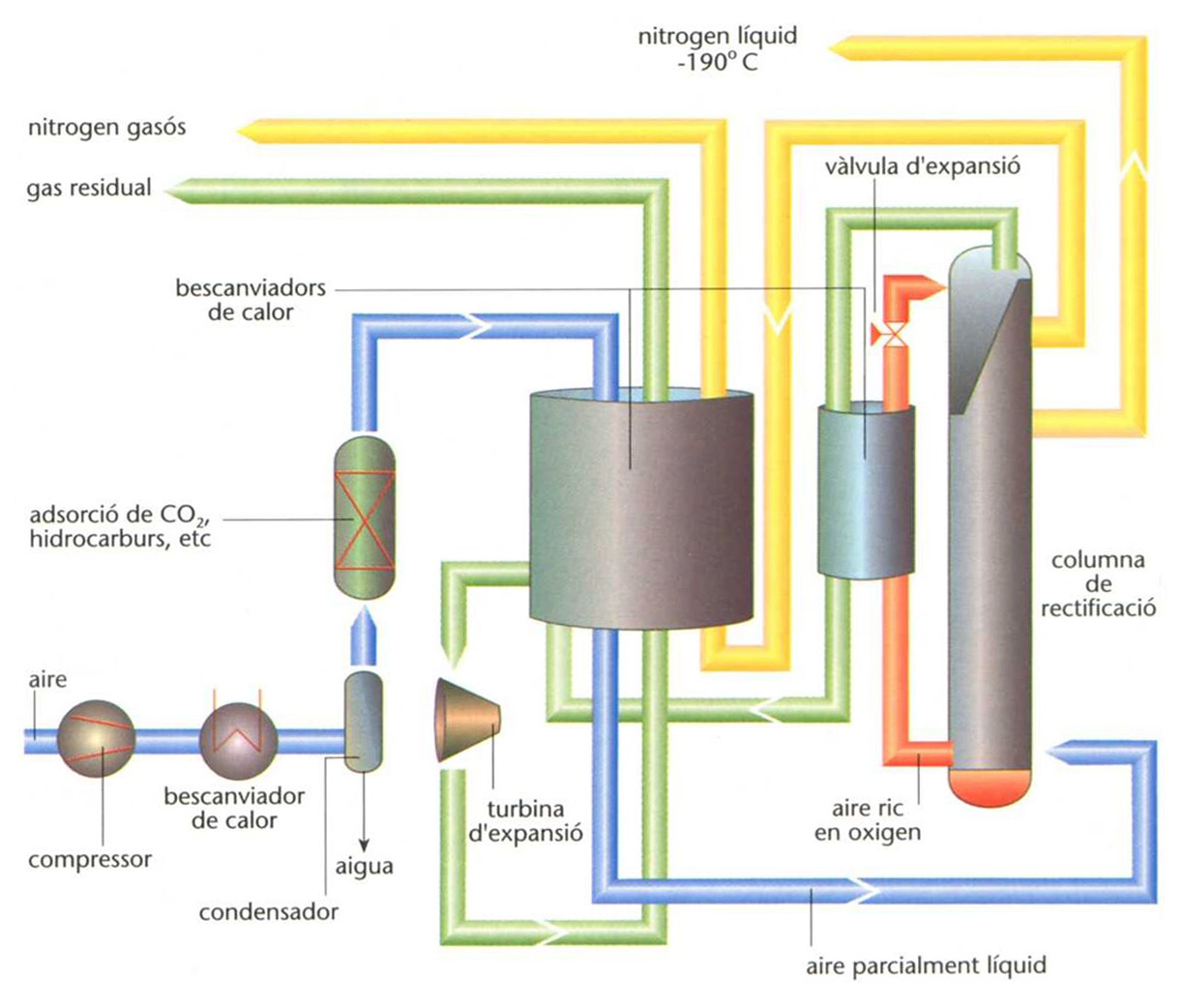
Diagrama de flux del procediment d’obtenció del nitrogen a partir de l’aire líquid en tres etapes: depuració de l’aire gasós (consideració de l’aigua i adsorció d’impureses amb matisos moleculars de zeolites), condensació parcial de l’aire (refrigeració a baixa temperatura en un bescanviador de calor) i destil·lació fraccionada a una pressió de 0,6-1 MPa (columna de rectificació); l’expansió del gas residual (turbina) és la font de condensació
© Fototeca.cat
Química
Element químic no metàl·lic pertanyent al grup VA de la taula periòdica, situat entre el carboni i l’oxigen.
És un gas incolor, inodor i insípid, i és l’element més lleuger del grup Fou descobert per D Rutherford el 1772, i a la mateixa època, també per H Cavendish i J Priestley El nitrogen natural és format pels isòtops naturals 14 N i 15 N i pels isòtops radioactius 12 N, 13 N, 16 N i 17 N En estat natural el nitrogen molecular, a la temperatura ambient, és un gas que constitueix una gran part de l’atmosfera l’aire sec en conté un 78,09% en volum En estat combinat és un dels principals constituents de les proteïnes animals i vegetals i d’un gran nombre de substàncies orgàniques El nitrat de Xile…