Resultats de la cerca
Es mostren 34 resultats
anhidre | anhidra
Química
Dit de la substància o del producte destituït d’aigua, especialment dels sòlids sense aigua de cristal·lització, quan poden cristal·litzar amb aigua, i dels composts inorgànics líquids que dissolen aigua.
Dels líquids orgànics, els gasos i els sòlids sense aigua absorbida, hom sol dir que són secs, no pas anhidres
clorur d’alumini
Química
Clorur anhidre AlCl3 (o més exactament Al2Cl6) que forma pólvores blanques sublimables a 183°C que fumegen a l’aire humit i són obtingudes en gran escala fent passar clor sobre una mescla de carboni i bauxita a alta temperatura: .
És molt utilitzat com a catalitzador en la indústria del petroli En química orgànica és el catalitzador més important de la reacció de Friedel i Crafts Amb l’aigua dóna un hidrat AlCl 3 6H 2 O, compost cristallí hidrolitzable obtingut tractant amb àcid clorhídric l’alumini o el seu hidròxid El clorur d’alumini anhidre dóna també composts d’addició amb nombroses substàncies
alcohol absolut
Química
Etanol pur, del qual ha estat eliminada totalment l’aigua.
L’alcohol absolut no emblaveix el sulfat de coure anhidre ni dóna acetilè amb el carbur de calci En la pràctica, l’alcohol absolut industrial conté, encara, molt sovint, traces d’aigua, i el seu grau és de 99,5-99,9 La deshidratació pot ésser efectuada tractant amb deshidratants calç viva, sulfat càlcic anhidre, etc i destillant, o bé per destillació azeotròpica, per exemple, amb benzè
superàcid
Química
Nom genèric de certs àcids amb un índex d’acidesa milions de vegades més gran que el del sulfúric.
Hom els obté, generalment, barrejant un àcid de Lewis i un àcid de Brønsted en medi anhidre
glioxal
Química
Dialdehid obtingut a partir de l’acetaldehid per oxidació amb àcid nítric o diòxid de seleni.
El polímer anhidre passa a monòmer per escalfament La seva dissolució aquosa conté diversos oligòmers hidratats i reacciona com un àcid feble
amidur de sodi
Química
Pólvores cristal·lines blanques d’olor d’amoníac, que es fonen a 210°C.
És una base forta que es descompon per l’acció de l’aigua i altres dissolvents hidroxilats Hom l’obté per l’acció de l’amoníac anhidre sobre sodi fos i és emprat en la síntesi del cianur sòdic i com a base en síntesi orgànica És també conegut com a sodamida
aigua de cristal·lització
Farmàcia
Química
En un sentit més lat, la totalitat de l’aigua dels hidrats formats per evaporació o refredament de solucions aquoses, tant si és parcialment o totalment aigua de constitució
com si és pròpiament aigua de cristal·lització.
La pèrdua de l’aigua de cristallització per escalfament o per eflorescència és causa de la destrucció dels cristalls macroscòpics, però el producte anhidre obtingut també és, en general, cristallí, o sigui que hi ha només canvi d’estructura En termes generals, doncs, l’aigua no és indispensable a la cristallització de la substància
sulfonal
Farmàcia
Química
Sulfona alifàtica amb notable activitat hipnòtica.
És un sòlid cristallí incolor, estable als àcids i les bases, soluble en l’aigua calenta, que es fon a 126°C Hom l’obté per tractament de l’acetona amb tiosulfat de sodi i S-etil sal de Bunte i posterior oxidació amb permanganat potàssic en medi anhidre Ha estat emprat en medicina com a hipnòtic, però modernament ha estat substituït per altres composts, especialment el veronal
al·loxana
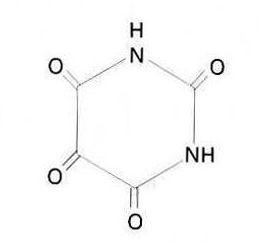
Al·loxana
©
Química
Compost heterocíclic.
Forma un tetrahidrat i un monohidrat anhidre, esdevé rosa a 230 °C i es fon a 256 °C És soluble en aigua, alcohol i acetona les solucions aquoses són àcides al tornassol, donen a la pell una coloració vermella i fan una olor desagradable És obtinguda per oxidació de l’àcid úric i és utilitzada en síntesi orgànica i en la investigació bioquímica, per a produir diabetis en animals experimentals
hidrat
Química
Substància que conté molècules d’aigua que formen part de la seva composició química.
Hom distingeix dos tipus d’hidrats el primer tipus és format pels hidrats de composició constant, en els quals les molècules d’aigua són lligades al compost anhidre mitjançant enllaços covalents coordinats per un dels parells d’electrons lliures de l’àtom d’oxigen, o bé per enllaços de ponts d’hidrogen i en el segon tipus les molècules d’aigua ocupen buits en la xarxa cristallina i no presenten una proporció constant entre els dos components de l’hidrat