Resultats de la cerca
Es mostren 13 resultats
Richard Abegg
Química
Químic alemany.
Fou professor a Breslau 1899 Feu estudis sobre electroafinitat suggerí que l’enllaç iònic era conseqüència de transferència de càrregues elèctriques i atracció electroestàtica Contribuí a la teoria de la valència regla d’Abegg
model atòmic de Rutherford
Física
Química
Model atòmic postulat per E. Rutherford l’any 1911 com a conseqüència de les seves observacions respecte al bombardeig de làmines metàl·liques amb partícules (experiment de Rutherford).
Rutherford proposà que l’àtom és constituït per un nucli, el qual té concentrada tota la càrrega positiva i la quasi totalitat de la massa atòmica, i, girant entorn d’aquest a distàncies grans, els electrons, amb una velocitat tal, que llur força centrífuga ha de compensar la força d’atracció electroestàtica exercida pel nucli D’altra banda, la natura neutra de l’àtom exigeix que el nombre de càrregues positives del nucli sigui igual al nombre d’electrons que giren entorn seu
antiestàtic
Química
Compost que dóna conductivitat suficient a superfícies normalment no conductores per a evitar que s’hi acumulin càrregues elèctriques estàtiques, produïdes generalment per fricció.
Els antiestàtics són emprats per a productes tèxtils, plàstics, resines, paper, cuir, poliments a base de ceres, etc, i disminueixen o eviten les dificultats en el maneig de certs articles, l’atracció i l’adherència de la pols i àdhuc el perill d’incendi Poden ésser incorporats al material, o aplicats superficialment a l’article acabat, i llur acció pot ésser temporal o durable Molts d’ells actuen simplement fent possible la retenció d’humitat Els productes emprats com a antiestàtics són molt diversos i comprenen amines i amides de cadena llarga, bases i sals d’amoni quaternaris…
cohesió
Física
Química
Força que manté unides les molècules d’un sòlid o d’un fluid a conseqüència de l’atracció molecular.
radi de van der Waals
Química
Pel que fa als cristalls moleculars d’elements no metàl·lics o de llurs composts covalents, valor definit per a cada element com la meitat de la distància d’equilibri entre els dos àtoms més pròxims d’aquest no enllaçats entre ells.
Els radis de van der Waals són una conseqüència de les forces intermoleculars d’atracció i repulsió forces de van der Waals i hom els pot considerar com una mesura de la distància mínima a la qual poden apropar-se dos àtoms sense establir un enllaç covalent La determinació experimental d’aquests radis és realitzada mitjançant la difracció de raigs X, i llur valor presenta una oscillació de ±0,05 Å, segons el compost en el qual han estat determinats Els valors numèrics dels radis de van der Waals s’aproximen als dels corresponents radis iònics dels mateixos elements, atès que…
ió
Física
Química
Àtom o grup d’àtoms que tenen una càrrega elèctrica deguda a la pèrdua (ió positiu) o a la captura (ió negatiu) d’electrons.
Atesa la càrrega elèctrica dels ions, quan són sotmesos a l’acció d’un camp elèctric es desplacen vers l’elèctrode de signe oposat, i hom anomena cations catió els de càrrega positiva i anions anió els de càrrega negativa Els ions electrolítics foren estudiats per M Faraday, S Arrhenius i F Kohlrausch Hom representa un ió amb el símbol de l’element i un exponent Na + , Fe 3 + , PO 3 - 4 , que indica el signe de l’ió i el seu grau d’ionització El diàmetre dels ions augmenta amb llur nombre atòmic La tendència dels ions a ésser polaritzats elèctricament és proporcional a llur volum aquesta…
ió carboni
Química
Catió orgànic en què el defecte de càrrega electrònica és localitzat en un àtom de carboni.
Els ions carboni són, per tant, electròfils , i posseeixen una gran reactivitat envers reactius que puguin fornir parells d’electrons i formar amb ells un enllaç covalent Són espècies d’existència transitòria dins el curs d’una reacció i tendeixen a unir-se amb el catalitzador present o a autostabilitzar-se per atracció d’un parell d’electrons d’un àtom de carboni o d’un grup adjacent tot formant un doble enllaç L’estabilitat relativa dels ions carboni depèn en darrer terme de la possibilitat de repartiment de la càrrega positiva de l’àtom de carboni sobre els àtoms adjacents…
llei de Raoult
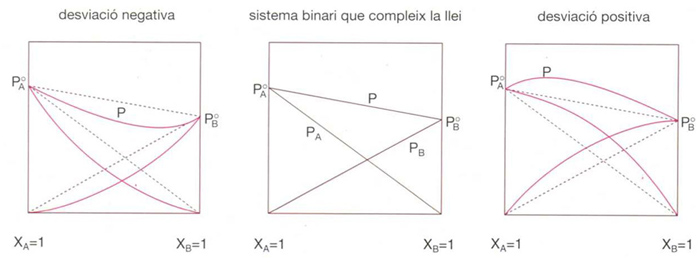
Llei de Raoult
Química
Relació descoberta per F. M. Raoult l’any 1887 en estudiar la pressió de vapor de solucions salines.
Estableix que el descens relatiu de la pressió de vapor d’un líquid pur i en dissoldre-hi una substància no volàtil s , és proporcional a la fracció molar d’aquesta p i o - p i /p i o = x s = 1- x i La llei de Raoult pot ésser també aplicada a mescles líquides binàries i d’ordre superior amb la següent formulació la pressió de vapor parcial del component i p i és igual a la pressió de vapor del líquid i p i o pur a la mateixa temperatura multiplicada per la seva fracció molar en la mescla p i = p i o x i Molt poques solucions compleixen la llei de Raoult en un interval ample de…
adhesió
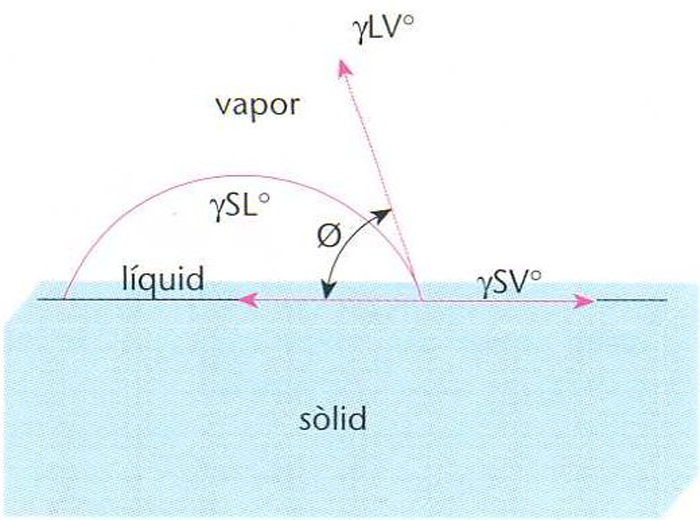
Angle de contacte ϑ en l’adhesió entre sòlid i líquid
© fototeca.cat
Química
Fenomen per mitjà del qual dues superfícies són mantingudes juntes per forces intermoleculars.
L’adhesió pot ésser mecànica, electroestàtica o per atracció molecular, segons que la seva dependència sigui funció, respectivament, d’una interacció mecànica, d’una atracció de càrregues elèctriques o d’una força de valències Des del punt de vista termodinàmic presenta dos punts que defineixen el sistema les condicions necessàries per a establir el contacte interfacial o mullabilitat les condicions necessàries per a dur a terme aquest contacte, l’adhesió, que controla la força d’adhesió Les condicions termodinàmiques de mullament i estesa d’un líquid sobre un sòlid…
aigua de cristal·lització
Farmàcia
Química
En sentit estricte, aigua continguda en proporció fixa en els hidrats cristal·litzats, quan és unida només per atracció de dipols, però que contribueix tanmateix a l’estabilitat de l’edifici cristal·lí.