Resultats de la cerca
Es mostren 48 resultats
elèctrode d’hidrogen
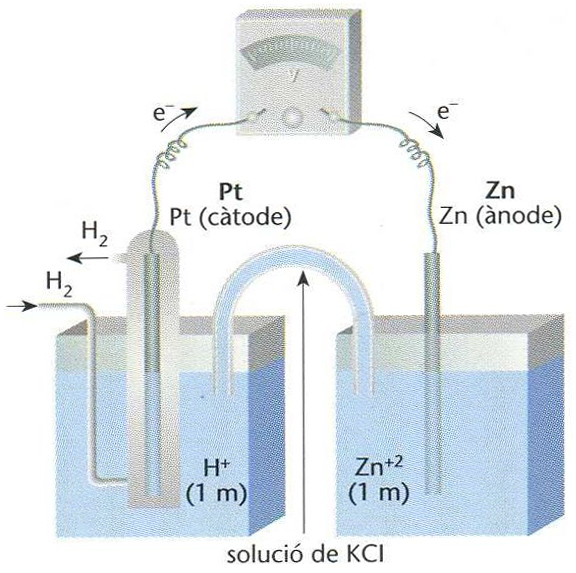
Elèctrode d’hidrogen que actua com a càtode en una cel·lula electroquímica
© Fototeca.cat
Química
Elèctrode de platí entorn del qual bombolleja hidrogen.
Hom acostuma a prendre com a potencial zero el d’un elèctrode d’hidrogen, a la pressió atmosfèrica, en una solució d’ions hidrogen d’activitat unitat És emprat com a elèctrode de referència
potencial d’elèctrode
Potencial d’elèctrode
©
Química
Estat d’equilibri elèctric d’una substància (element químic o compost) que és submergida en una dissolució que la conté en forma iònica.
Formalment, és expressat per la equació o llei de Nernst El potencial d’elèctrode d’una substància no pot ésser mesurat d’una manera absoluta, sinó formant una pila amb una altra que és presa com a referència de potencial zero Hom acostuma a prendre com a referència l' elèctrode d'hidrogen o l' elèctrode de calomelans
elèctrode de calomelans
Química
Elèctrode de referència de preparació fàcil i de potencial molt constant, emprat en substitució de l’elèctrode normal d’hidrogen.
Consta d’un dipòsit de mercuri cobert d’una pasta de calomelans i mercuri, la qual és en contacte amb una dissolució de concentració coneguda de clorur de potassi saturada de calomelans Els potencials que produeix l’elèctrode de calomelans amb una concentració 0,1N, 1N i saturada de clorur de potassi a 25°C relatius a l’elèctrode normal d’hidrogen són, respectivament, 0,3371, 0,2846 i 0,2458 volts
elèctrode de quinhidrona
Química
Elèctrode basat en el sistema redox i constituït per la p-benzoquinona i la hidroquinona: .
Hom prepara l’elèctrode dissolent una quantitat de quinhidrona en el sistema a estudiar En aquestes condicions, el potencial adquirit per un elèctrode inatacable submergit en la dissolució és donat per l’expressió E = E° - RT/F ln a H + , sempre que hom pugui suposar que les activitats de la p- benzoquinona i de la hidroquinona són idèntiques L’elèctrode de quinhidrona es comporta aleshores com un elèctrode d’hidrogen, amb un valor de E° = -0,6994 + 0,00074 t , on t és una temperatura entre 0 i 37°C Com a conseqüència, l’elèctrode…
elèctrode d’antimoni
Química
Elèctrode per a mesures de pH de no gaire precisió, constituït simplement per una barreta d’antimoni que, recoberta espontàniament d’òxid, funciona com un elèctrode d’òxid Sb/Sb2O3
.
El potencial no és el teòric, però, per calibratge amb un elèctrode d’hidrogen, hom pot realitzar mesures satisfactòries, sobretot entre els pH 2,2 i 7,8 i en medi no reductor L’elèctrode d’antimoni ha perdut tot interès pràctic per a les mesures de pH a causa de la generalització i perfeccionament dels aparells que permeten la utilització de l’elèctrode de vidre, però és emprat per a potenciometries en solvents no aquosos
elèctrode de vidre
Química
Elèctrode consistent en un tub de vidre en forma de bulb, de parets molt fines, que actua com a membrana semipermeable als ions H+
.
És el més emprat per a la mesura del pH Quan conté una solució 0,1 M d’àcid clorhídric i hom l’empra amb referència a l’elèctrode de calomelans, el pH de les solucions que hom mesura és donat per l’expressió pH Y 16,903 E E 1,873 25°C L’elèctrode de vidre pot ésser emprat per a la mesura del pH entre 0 i 13 i no és afectat per oxidants, reductors ni composts orgànics
voltàmetre
Química
Aparell destinat a mesurar una quantitat d’electricitat segons la quantitat d’un cos alliberat electroquímicament en un elèctrode.
Hom determina el volum del gas alliberat voltàmetres de volum o mesura el pes de l’elèctrode per a determinar la quantitat del cos dipositat en l’elèctrode voltàmetres de pes
sobretensió
Química
Diferència entre el potencial Ei que adquireix un elèctrode pel qual circula un corrent elèctric i el potencial d’equilibri Eo que adquireix l’elèctrode en contacte amb la solució quan no passa corrent a través d’ell, definida per η = Ei — Eo
.
El concepte de sobretensió és relacionat amb el de polarització , de manera que, quan hi ha una sola reacció d’elèctrode, ambdós conceptes són sinònims El signe de la sobretensió és el mateix que el de la densitat de corrent L’existència de la sobretensió pot anar associada a qualsevol de les etapes d’una reacció d’elèctrode, de manera que la sobretensió total η, única mesurable experimentalment, pot descompondre's formalment en una sobretensió de difusió η d , originada pel transport dels reactants, una sobretensió de transferència de càrrega η t i una sobretensió de…
cronopotenciometria
Química
Tècnica electroanalítica basada en la determinació de la variació, en funció del temps, del potencial d’un elèctrode actiu durant l’electròlisi, a corrent constant, de la solució problema.
Aquest potencial depèn de la natura de la substància que reacciona i, a mesura que en el transcurs de l’electròlisi varia la raó de les concentracions de les formes oxidada i reduïda d’aquesta substància en la capa de solució immediata a l’elèctrode, va variant suaument Com que la substància electroactiva només pot arribar a aquesta capa per difusió per tal com hom hi evita, pels mètodes usuals en electroanàlisi, els mecanismes de transport per migració iònica i per convecció, arriba un moment que la concentració tendeix a zero En aquest moment, el potencial de l’elèctrode…
potenciometria
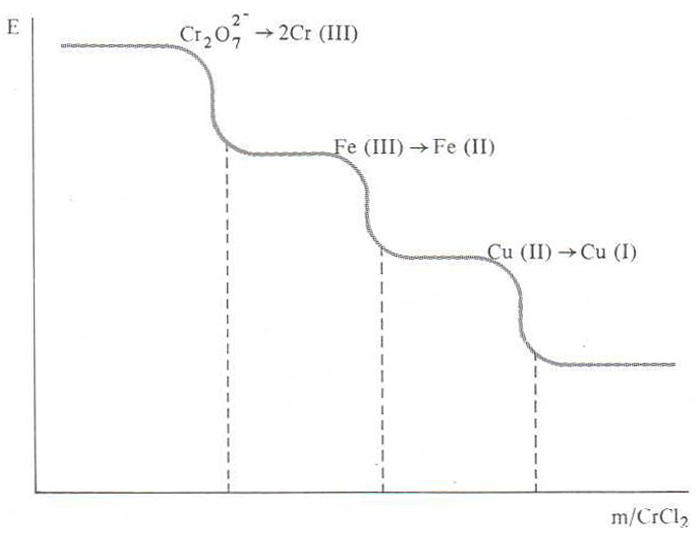
Potenciometria
© Fototeca.cat
Química
Procediment analític utilitzat per a determinar el punt final de les volumetries, basat en la variació del potencial d’un elèctrode en funció de la variació de la concentració dels ions de l’element que el constitueix en la dissolució problema, d’acord amb l’equació (o llei) de Nernst, al llarg de l’addició d’un reactiu valorant.
Aquesta tècnica troba aplicació en volumetries àcid-base, atesa la dependència del potencial d’un elèctrode, com el d’hidrogen, emprat comunament com a referència, amb la concentració dels seus ions en el si de la dissolució a valorar, i el punt final es caracteritza per una sobtada variació del potencial en afegir una petita quantitat del reactiu valorant també troba aplicació en les volumetries de precipitació, amb un fonament anàleg al de les àcid-base, i és de gran valor per a la determinació d’halogenurs i de cianur amb l’ió argent, Ag + Amb tot, l’aplicació fonamental del…