Resultats de la cerca
Es mostren 21 resultats
dissociació iònica
Química
Reacció d’equilibri entre una substància en solució i els seus ions.
Segons Svante Arrhenius 1887, les propietats especials de les solucions de tots els electròlits són explicades acceptant que s’hi dóna una fracció de l’electròlit dissociada en ions en equilibri amb la forma molecular no dissociada, equilibri que compleix les lleis generals de les reaccions reversibles Així, hom pot definir una constant de dissociació, determinada a partir del grau de dissociació fracció dissociada, el qual depèn de la concentració i que hom pot avaluar experimentalment a partir de mesures de la conductivitat elèctrica o dels valors de les propietats colligatives…
diàlisi
Química
En una solució, procés de separació dels soluts segons llur velocitat de difusió a través d’una membrana semipermeable adequada.
La diàlisi permet, per exemple, de purificar les solucions de proteïnes i altres biopolímers eliminant les substàncies de poc pes molecular i els possibles electròlits presents, i és el procés en què hom basa l'hemodiàlisi
Niels Bjerrum
Química
Químic danès, deixeble de Julius Thomsen i de Walter Nernst, professor del col·legi de veterinària i agricultura de Copenhaguen.
Feu importants aportacions en el camp de la química física i de l’electroquímica, amb estudis sobre la teoria àcid-base, la mesura de la concentració d’ions hidrogen i els electròlits amfòters Aplicà la teoria quàntica a l’estudi de les calors específiques dels gasos
clortalidona
Farmàcia
Química
Substància estructuralment semblant a les tiazides i amb propietats diürètiques similars.
Es presenta en forma de pólvores cristallines de color blanc que es fonen amb descomposició aproximadament a 220°C Inhibeix la reabsorció dels electròlits pels túbuls renals, fet que augmenta l’eliminació del sodi, del clor i de l’aigua En medicina és emprada com a diürètic i en el tractament de la hipertensió
Svante August Arrhenius
Química
Químic suec, un dels fundadors de la química moderna.
Treballà amb Wilhelm Ostwald a Riga, amb Ludwig Boltzmann a Graz, amb Friedrich Kohlrausch a Würzburg i amb Jacobus H van't Hoff a Amsterdam Tornà a Suècia el 1891 Fou rector de la Universitat d’Estocolm, d’ençà del 1905, i director de l’institut de química física de la fundació Nobel A partir del 1883 anà establint la teoria de la dissociació iònica dels electròlits en solució diluïda, que publicà el 1887 i per la qual rebé el premi Nobel de Química del 1903 La seva teoria, ja intuïda per Berthollet, dóna una explicació dels fenòmens de la conductivitat elèctrica de les…
anàlisi conductomètrica
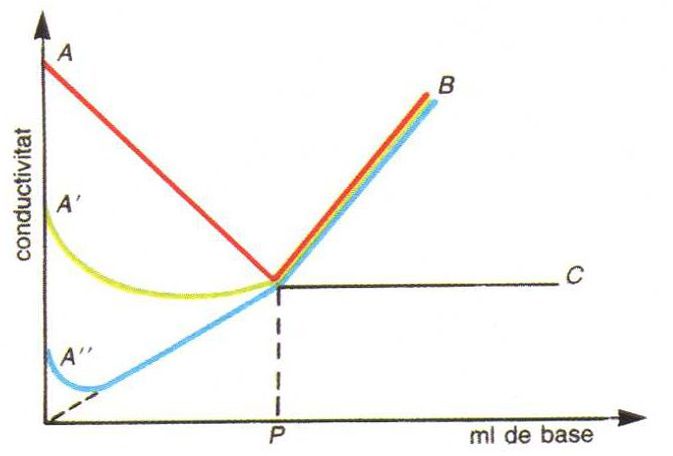
Valoració conductomètrica d’un àcid amb una base: corba AB, àcid fort amb una base forta; corba A'B, àcid mitjanament fort amb una base forta; corba A''B àcid feble amb una base feble; P, punt d’equivalència
©
Química
Procediment analític usat per a determinar el punt final de les volumetries, basat en la mesura de la variació de la conductivitat electrolítica de la solució problema deguda a l’addició de reactiu valorant.
Com que la conductivitat electrolítica depèn de la mobilitat dels ions presents en la solució i de llurs concentracions, l’addició d’un reactiu en provoca canvis importants sempre que doni lloc a la desaparició d’una espècie iònica de la solució sigui per formació d’un compost poc dissociat o d’una sal insoluble i a la seva substitució per quantitats equivalents d’un dels ions del reactiu de mobilitat diferent de la de l’espècie eliminada Així, hom pot dur a terme conductimètricament volumetries de neutralització, de precipitació i de formació de complexos, però només en casos favorables…
electròlit
Química
Substància que, fosa o dissolta en un solvent ionitzant, es dissocia donant ions i, doncs, esdevé conductora de l’electricitat.
Els electròlits són generalment àcids, bases o sals, i hom els classifica en forts o febles, segons que llur dissociació sigui completa o no, i en ionòfors i ionògens, segons que els ions en estat sòlid preexisteixin o no La dissociació parcial de l’electròlit permet de parlar d’un grau de dissociació, que ha estat estudiat i interpretat mitjançant les teories d'Arrhenius i de Debye-Hückel La conductivitat electrolítica és producte del moviment dels ions positius i negatius, i això la diferencia de la conductivitat deguda als electrons cas de la conducció en els metalls i en els…
sol
Química
Sistema col·loidal consistent en la dispersió d’un sòlid en un líquid (col·loide).
Les propietats que permeten de diferenciar un sol de les solucions veritables són l’elevada dispersió de la llum efecte Tyndall, la lenta difusió i la molt menor variació, en comparació amb les solucions, de les propietats colligatives elevació del punt d’ebullició, descens del punt de congelació i pressió osmòtica, ocasionada per un pes determinat de medi dispers Des d’un punt de vista general, els sols poden ésser classificats en liòfils, liòfobs i mixts Els sols liòfils són veritables solucions de molècules grans en un solvent i es caracteritzen per una tensió superficial freqüentment…
cel·la electroquímica
Química
Dispositiu en el qual hom aconsegueix que s’efectuï una reacció química gràcies al forniment d’energia elèctrica (en el qual cas hom l’anomena cel·la electrolítica, i l’operació en conjunt rep el nom d’electròlisi) o en el qual, inversament, es produeix energia elèctrica a partir de l’energia alliberada per una reacció química que hi té lloc espontàniament (i és anomenat aleshores pila o cèl·lula voltaica).
Consisteix en un recipient que conté un o més electròlits units per ponts salins conductors o per parets poroses, amb dos elèctrodes immergits dins el líquid i connectats entre ells a través d’un circuit exterior En la cella té lloc, en tot cas, una reacció global d’oxidoreducció a l' ànode té lloc la semireacció d’oxidació, i al càtode , la de reducció Quan la cella funciona com a recinte d’una electròlisi, hom aplica una diferència de potencial als elèctrodes, amb la polaritat positiva a l’ànode i la negativa al càtode, per tal de proporcionar a aquest elèctrode els electrons…
coeficient d’activitat
Química
Quantitat γ per la qual cal multiplicar les pressions gasoses o les concentracions per a obtenir les activitats.
Amb les convencions usuals respecte als estats de referència, γ = a/P en el cas dels gasos i γ = a/c en el cas de les solucions Segons que la concentració sigui expressada en fracció molar, molalitat o molaritat, el valor numèric de γ varia L’interès dels coeficients d’activitat resideix en el fet que varien molt més lentament que les activitats i es presten millor, per tant, a les interpolacions i extrapolacions En el cas dels electròlits forts, com que és impossible calcular les activitats individuals dels ions, hom introdueix un coeficient d’activitat mitjà γ ± , deduïble de…