Resultats de la cerca
Es mostren 30 resultats
orbital atòmic
Química
Cadascuna de les funcions, solució de l’equació de Schrödinger, que descriuen l’estat estacionari d’un electró que forma part d’un àtom.
El concepte d’orbital fou introduït cap a les acaballes dels anys vint, coincidint amb el desenvolupament de la mecànica quàntica, que permeté de superar totes les dificultats que el model de l’àtom de Bohr plantejava Les funcions orbitals poden ésser reals o complexes i prendre, per a uns valors determinats de les coordenades, valors positius o negatius, no directament relacionables amb cap propietat observable de l’electró El producte de la funció d’ona per la seva conjugada és sempre real i representa la probabilitat de trobar l’electró en cada punt de l’espai Els orbitals són definits…
acoblament de Russell-Saunders
Física
Química
Model proposat per H.N. Russell i F.A. Saunders l’any 1925 per a explicar l’existència dels termes multiplets dels espectres atòmics dels àtoms amb més d’un electró òptic (espectre de ratlles).
En aquest model, hom suposa que els moments angulars dels diferents electrons l 1 , l 2 s’acoblen, i en resulta un moment angular total definit pel nombre quàntic L , que ha d’ésser enter i igual a la suma vectorial dels distints l i , i que, igualment, els moments angulars de spin s i s’acoblen per a donar un moment de spin total, definit pel nombre quàntic S Anàlogament com en un electró pot definir-se un moment angular total j i = l i + s i , podrà definir-se per al total d’electrons òptics un nombre quàntic J = L + S , que podrà prendre els valors de les distintes combinacions…
orbital molecular
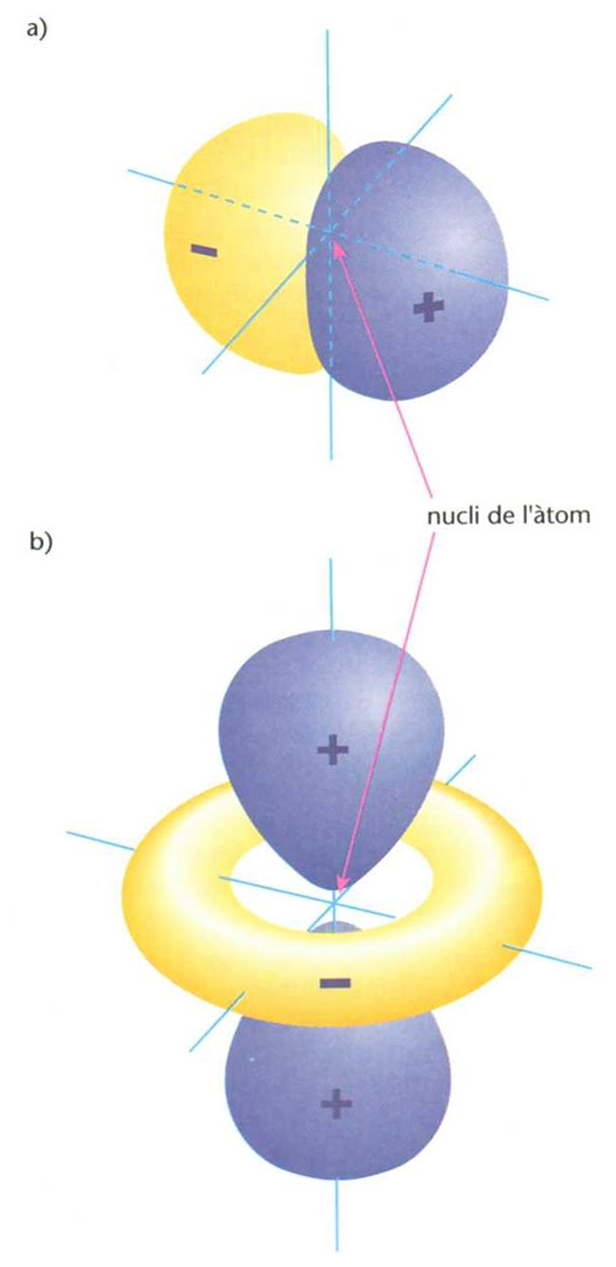
Representació tridimensional de dos orbitals (de nombres quàntics n=2,l = 1 (p) i m=1(a), i n =3,l = 2 (d) i m = 0 (b)) de l’àtom d’hidrogen en prèsencia de camp magnètic extern: assenyalen dos estats energètics de l’electró i la regió al voltant del nucli on és més probable de trobar l’electró en cadascun d’aquests dos estats (els valors de l i m determinen les dimensions, la forma i l’orentació de l’orbital): els caolors respresenten els signes + o - que pren la funció d’ona
© Fototeca.cat
Química
Cadascuna de les funcions d’ona, solució de l’equació de Schrödinger, associades a un electró que forma part d’una molècula.
Presenten les mateixes característiques matemàtiques que els orbitals atòmics Són de natura policèntrica i constitueixen en ells mateixos una interpretació de l’enllaç químic La descripció de l’estructura molecular mitjançant l’ús d’orbitals moleculars és coneguda com a teoria de l’enllaç dels orbitals moleculars , i consisteix a considerar inicialment la molècula com un conjunt de nuclis amb ordenació pròpia, determinar els diversos orbitals de nuclis i omplir els orbitals multicèntrics així obtinguts amb els electrons de la molècula, mitjançant un procediment anàleg al seguit per a establir…
ressonància de spin electrònic
Química
Tècnica analítica, de fonament anàleg al de la ressonància magnètica nuclear, que pot ésser aplicada únicament a substàncies paramagnètiques, és a dir, amb electrons desaparellats.
Es basa en les variacions de les poblacions dels diversos nivells energètics deguts al moment magnètic electrònic, quan la substància, disposada en un camp magnètic d’intensitat constant, és sotmesa a una irradiació de freqüència apropiada radiofreqüència-microona La separació dels nivells energètics és relacionada amb el valor del camp magnètic aplicat H per l’expressió essent g el factor de Landé propi de cada electró desaparellat, h la constant de Planck i μ Β el magnetó de Bohr En el cas d’una molècula amb un sol electró lliure, l’espectre és constituït per una sola línia, generalment…
període
Química
Cadascuna de les fileres horitzontals de la taula periòdica dels elements
.
Hom considera que un període comença amb l’element que incorpora el primer electró corresponent a una nova capa quàntica principal i s’acaba amb el que inclou l’electró que completa l’octet corresponent en aquesta capa, excepte en el cas del primer període, el qual, pel fet de contenir únicament un orbital s , és integrat per dos elements, l’hidrogen i l’heli Existeixen set períodes, els quals consten de 2, 8, 8, 18, 18, 32 i 32 elements, respectivament, tot i que del darrer període hom en coneixia el 1987 només 23
model atòmic de Schrödinger
Física
Química
Model derivat de l’aplicació de l’equació de Schrödinger (Hψ = Eψ) per a l’estudi de l’estructura atòmica.
Per a un sistema determinat, les diferents funcions pròpies ψ, solucions de l’equació, són conegudes com a orbitals orbital , i són caracteritzades per uns valors propis que corresponen a l’energia dels esmentats orbitals El mòdul al quadrat de la funció ψ té el significat de la probabilitat de localització de l’electró que descriu l’esmentada funció en una regió determinada de l’espai, i la seva representació gràfica constitueix la imatge visual dels orbitals, habitualment emprada pels químics El coneixement exacte del hamiltonià H pot ésser únicament assolit en els sistemes que consten d’…
halogen
Química
Qualsevol dels elements químics del grup VII A de la taula periòdica: fluor (F), clor (Cl), brom (Br), iode (I) i àstat (At).
Són representats genèricament per X Hom pot observar una gradació de propietats del fluor al iode enfosquiment del color, creixement de la densitat, de les temperatures de fusió i d’ebullició, de les calors de fusió i de vaporització, dels radis atòmics i iònics, i una disminució del potencial electroquímic i de l’escala d’electronegativitats A l’estat elemental, els halògens tenen tots una molècula diatòmica, i en llurs composts actuen amb els estats d’oxidació —1, 0, +1, +3, +5, +7 i també amb el de +4, amb l’excepció del fluor, que és l’element més electronegatiu i actua amb +1 Els àtoms…
tritil
Química
Radical derivat del trifenilmetà per pèrdua de l’hidrogen del seu únic carboni alifàtic.
Fou un dels primers radicals lliures coneguts, i presenta una estabilitat moderada, a causa de la deslocalització per ressonància de l’electró desaparellat i de la congestió estèrica