Resultats de la cerca
Es mostren 81 resultats
ionització
Física
Química
Procés de ruptura dels enllaços electrònics en els àtoms, que produeix la formació de parelles d’ions de càrregues oposades.
Els principals mecanismes d’ionització són la collisió dels àtoms o molècules amb altres àtoms i ions, la interacció amb algun tipus de radiació i l’aportació de calor
energia d’ionització
Física
Química
Energia necessària perquè un electró lligat a un àtom o a una molècula pugui escapar-se del sistema al qual pertany.
Hom la mesura en eV
constant d’ionització
Química
Constant d'equilibri del procés d'ionització d'una espècie química, d'un àcid, d'una base o d'una sal.
reacció heterolítica
Química
Reacció en la qual es produeix la ruptura d’un enllaç d’una forma heterogènia, és a dir, el parell d’electrons que formen l’enllaç resten sobre un dels fragments que es produeix, mentre que sobre l’altre fragment resta un buit electrònic.
Aquesta ruptura proporciona ions Totes les reaccions d’ionització pertanyen a aquest tipus de reacció
argó
Química
Element gasós, incolor, inodor i no tòxic, el més abundant dels gasos rars (gas noble).
La seva presència a l’atmosfera terrestre 0,934% en volum fou confirmada per John William Rayleigh el 1892 aire William Ramsay l’aïllà el 1894 L’argó atmosfèric és constituït per una mescla de tres isòtops 36 Ar, 38 Ar i 40 Ar, el darrer dels quals és, de molt, el més abundant 99,6% Diversos isòtops radioactius han estat també obtinguts artificialment L’argó és obtingut industrialment com a subproducte en fàbriques que treballen amb aire com a primera matèria i és subministrat en bombones d’acer sota una pressió de 150 kg/cm 2 , amb pureses del 99,9% o més, segons els usos Com els altres…
indicadors de Fajans
Química
Cadascun dels indicadors del grup introduït en anàlisi volumètrica per K. Fajans el 1923 per a la detecció del punt final de les volumetries de precipitació, caracteritzats pel fet de tenir diferent color quan es troben lliures en solució i quan es troben adsorbits sobre la superfície del precipitat format en la volumetria, també anomenats indicadors d’adsorció.
Aquests indicadors són àcids febles com la fluoresceïna, la diclorofluoresceïna o l’eosina o bases febles com la rodamina 6 G i l’etoxicrisoïdina, i poden ésser emprats només en un camp de pH limitat segons la valor de llur constant d’ionització
cromatògraf de gasos
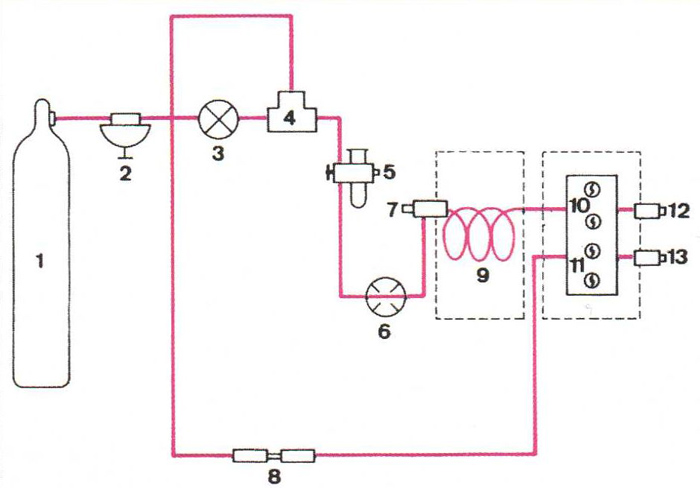
Esquema d’un cromatògraf de gasos: 1, bombona de gas portador; 2, vàlvula reductora; 3, vàlvula de regulació fina; 4, cabalímetre; 5, vàlvula de presa de mostra; 6, vàlvula antiretorn; 7, punt d’injecció de la mostra; 8, calibrador del flux de referència; 9, columna; 10, filaments de mesura; 11, filaments de referència; 12, col·lector escalfat; 13, sortida del flux de referència
© fototeca.cat
Química
Aparell emprat per a la separació i la identificació de gasos i líquids volàtils.
Hom injecta la mostra problema dins el corrent de gas portador He, N 2 , Ar, el qual és introduït a la columna plena d’un suport sòlid inert impregnat d’un líquid no volàtil Els components se separen a causa de llurs diferents velocitats de migració, i el corrent que en surt passa a un sistema detector d’ionització de flama, de captura d’electrons, i d’altres El registre del senyal d’aquest detector constituiex la corba d’elució, sobre la qual hom identifica i determina cada component de la mostra
electronegativitat
Química
Capacitat que té un àtom per a atreure’s els electrons de l’enllaç covalent que forma amb un altre àtom, és a dir, tendència que presenta un àtom a compartir desigualment els electrons de l’orbital o els orbitals del seu enllaç.
Hom ha convingut d’acceptar com a valor de l’electronegativitat d’un element el valor que aquest agafa en combinar-se amb l’hidrogen L’escala d’electronegativitats fou calculada per primera vegada per Linus Pauling a partir dels moments dipolars, electroafinitats i potencials d’ionització, bo i donant com a valor patró 4,0 per al fluor L’electronegativitat és emprada en fórmules empíriques per a calcular el caràcter iònic d’un enllaç i també per a calcular de manera aproximada la longitud d’enllaç a partir de la longitud dels radis covalents
Paginació
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- Pàgina següent
- Última pàgina