Resultats de la cerca
Es mostren 13 resultats
polarització
Química
Fenomen que provoca que, en un electròlit, la tensió d’un elèctrode o d’un element galvànic sigui diferent quan hi ha pas de corrent o quan aquest és nul.
Té una particular importància a les piles pila, on, per efectes diversos sobretot deposició dels gasos despresos pel corrent, i especialment hidrogen a l’elèctrode positiu, disminueix la tensió útil Per a combatre-la hom incorpora a la pila el despolaritzador adequat
despolarització
Química
Operació consistent a eliminar la polarització de piles o bateries.
Hom ho aconsegueix per eliminació dels productes de la reacció que s’acumulen en els elèctrodes Hom constata que l’origen de la polarització és generalment l’acumulació d’hidrogen al voltant de l’elèctrode positiu, la qual cosa crea una barrera aïllant que augmenta la resistència interna i, com a conseqüència, fa disminuir i, fins i tot, anulla el pas del corrent elèctric
oscil·lometria
Química
Tipus d’anàlisi conductimètrica en la qual hom treballa amb corrents alterns d’alta freqüència (1-300 MHz).
L’oscillometria es basa en el fenomen de polarització molecular que resulta de l’aplicació de corrents d’alta freqüència i que provoca un corrent de polarització d’intensitat comparable a la del corrent de conducció Segons que la substància a valorar estigui més dissociada o menys, predominarà l’un tipus de corrent o l’altre en el procés global de conducció En aquesta tècnica, els elèctrodes són externs i la cella conductimètrica actua com a capacitància i impedància en el circuit Presenta l’avantatge de no necessitar celles especials, a més dels avantatges derivats del fet d’ésser externs…
regles de Fajans
Química
Regles qualitatives donades per Fajans el 1923 que indiquen que, en un conjunt de substàncies químicament similars amb enllaç fonamentalment iònic, el caràcter covalent augmenta en els següents casos: amb la càrrega dels ions, quan el catió és petit i l’anió és gros i quan el catió té una configuració electrònica que no és la d’un gas noble.
Les regles de Fajans deriven de la consideració de la polaritzabilitat i del poder polaritzant dels ions, car el caràcter parcialment covalent de l’enllaç prové sobretot de la polarització de l’anió, que augmenta la densitat electrònica entre els nuclis
poder polaritzant
Química
Capacitat d’un ió de provocar la polarització d’un ió de signe contrari.
És important sobretot per als cations Augmenta amb el quocient càrrega/radi 2 i depèn de la configuració electrònica, essent més gran quan l’ió no té la configuració de gas noble regles deFajans
sobretensió
Química
Diferència entre el potencial Ei que adquireix un elèctrode pel qual circula un corrent elèctric i el potencial d’equilibri Eo que adquireix l’elèctrode en contacte amb la solució quan no passa corrent a través d’ell, definida per η = Ei — Eo
.
El concepte de sobretensió és relacionat amb el de polarització , de manera que, quan hi ha una sola reacció d’elèctrode, ambdós conceptes són sinònims El signe de la sobretensió és el mateix que el de la densitat de corrent L’existència de la sobretensió pot anar associada a qualsevol de les etapes d’una reacció d’elèctrode, de manera que la sobretensió total η, única mesurable experimentalment, pot descompondre's formalment en una sobretensió de difusió η d , originada pel transport dels reactants, una sobretensió de transferència de càrrega η t i una sobretensió de cristallització η c ,…
anàlisi conductomètrica
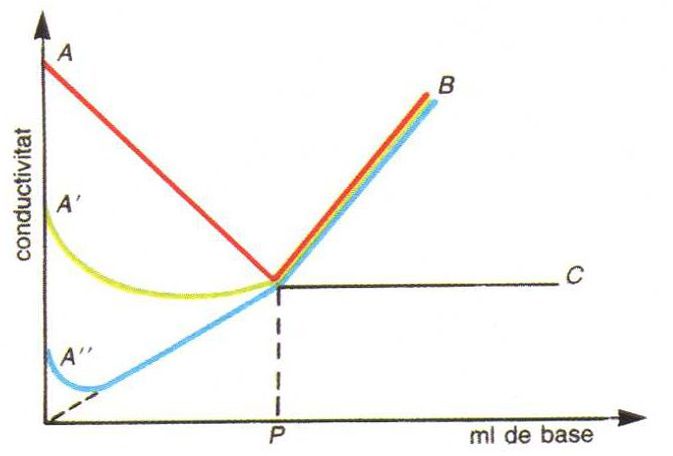
Valoració conductomètrica d’un àcid amb una base: corba AB, àcid fort amb una base forta; corba A'B, àcid mitjanament fort amb una base forta; corba A''B àcid feble amb una base feble; P, punt d’equivalència
©
Química
Procediment analític usat per a determinar el punt final de les volumetries, basat en la mesura de la variació de la conductivitat electrolítica de la solució problema deguda a l’addició de reactiu valorant.
Com que la conductivitat electrolítica depèn de la mobilitat dels ions presents en la solució i de llurs concentracions, l’addició d’un reactiu en provoca canvis importants sempre que doni lloc a la desaparició d’una espècie iònica de la solució sigui per formació d’un compost poc dissociat o d’una sal insoluble i a la seva substitució per quantitats equivalents d’un dels ions del reactiu de mobilitat diferent de la de l’espècie eliminada Així, hom pot dur a terme conductimètricament volumetries de neutralització, de precipitació i de formació de complexos, però només en casos favorables…
polarografia
fototeca.cat
©
Química
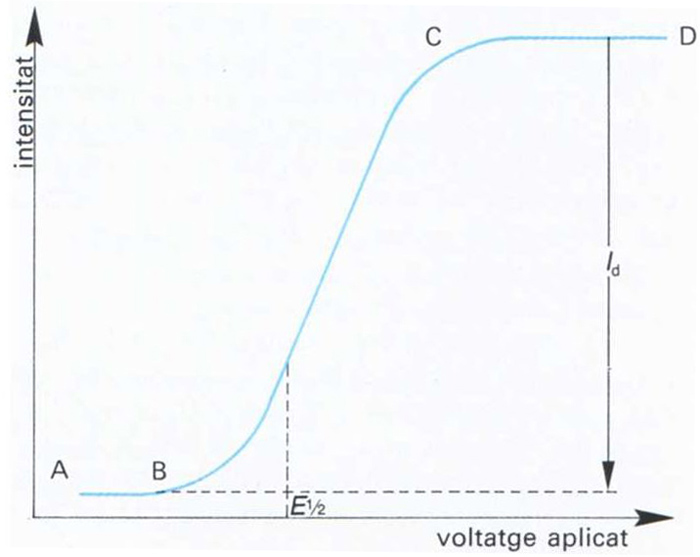
Branca de l’electroquímica que estudia la variació de la intensitat de corrent en funció del potencial aplicat a un microelèctrode en unes condicions en les quals la velocitat d’electròlisi és determinada per la difusió de l’espècie oxidable o reductible cap a l’esmentat elèctrode.
En les determinacions polarogràfiques hom empra una cella electrolítica consistent en un elèctrode d’àrea petita o microelèctrode El microelèctrode més comunament emprat és el de gotes de mercuri, consistent en un tub capillar molt fi a través del qual flueix lentament mercuri, que es desprèn en forma de gotes petites, les quals cauen sobre una gran superfície del mateix element, que constitueix l’altre elèctrode Quan hom aplica un voltatge variable a la cella, l’elèctrode de gran superfície resta inalterat, mentre que el microelèctrode experimenta un canvi de potencial, és a dir, es…
tiol
Química
Denominació genèrica dels composts orgànics caracteritzats per la presència d’un grup —SH enllaçat directament a un àtom de carboni.
El nom tiol ha substituït modernament la denominació mercaptà , que fa referència a la propietat, coneguda ja antigament, d’aquests composts, de combinar-se amb l’òxid de mercuri en solució aquosa D’acord amb les regles de la IUPAC, s’anomenen mitjançant el sufix tiol unit al nom del compost fonamental, com, per exemple, etantiol CH₃-CH₂-SH, o, quan existeix en el mateix compost un grup funcional més important, fent servir el prefix mercapto- , com és el cas de l’àcid mercaptoacètic HS-CH₂-COOH Els tiols ocorren a la natura com a constituents del petroli Hom els obté per diversos mètodes,…
protecció catòdica
Química
Procediment de protecció d’estructures metàl·liques contra la corrosió consistent en la polarització negativa de l’estructura amb relació al medi que l’envolta.
En efecte, qualsevol estructura metàllica enterrada o submergida en un líquid actua com un elèctrode en un electròlit, de forma que hi ha una tendència a la ionització del metall, és a dir, a la seva corrosió Hi ha tres sistemes de protecció catòdica el d' ànodes galvànics consisteix a disposar uns elèctrodes d’un metall més electronegatiu correntment Mg, Zn, Al que el metall a protegir correntment Fe, de manera que aquest actua com a càtode en la pila formada, i és, per tant, incorrosible, mentre els ànodes es van dissolent lentament i cal renovar-los el de transport de corrent consisteix en…