Resultats de la cerca
Es mostren 17 resultats
sal de Mohr
Química
Substància, sintetitzada per C. F. Mohr, que es presenta en forma de cristalls de color verd blavós, fluorescents i que s’oxiden en presència d’aire.
És soluble en aigua i insoluble en alcohol Hom l’empra en fotografia i en anàlisi volumètrica
Carl Friedrich Mohr
Química
Químic alemany.
Estudià farmàcia a les universitats de Berlín i Bonn i fou professor a la Universitat de Bonn 1867-79 Féu importants treballs d’anàlisi volumètrica, introduí l’ús de l’àcid oxàlic en alcalimetria i ideà la balança de Mohr per a determinar pesos específics de líquids i sòlids
volumetria
Química
Tècnica d’anàlisi química quantitativa que fa ús d’una reacció química entre solucions per tal de determinar la quantitat de substància, objecte de l’anàlisi, present en una mostra.
Consisteix en la mesura del volum de solució de reactiu, de concentració coneguda, que és necessari per a reaccionar totalment amb un volum mesurat de la solució de la substància problema La reacció química implicada en un procés volumètric ha d’acomplir determinades condicions, com ara que sigui ràpida i estequiomètrica i que presenti alguna característica que permeti de detectar amb precisió el punt final o d’equivalència En general, les reaccions que satisfan aquestes condicions transcorren entre espècies iòniques D’altra banda, les reaccions que impliquen formació o trencament d’enllaços…
solució sobresaturada
Química
Solució que, a una temperatura determinada, conté una quantitat de solut superior a la que pot estar en equilibri amb el solut no dissolt (solubilitat, producte de solubilitat).
Les solucions sobresaturades es troben en equilibri inestable, però hi ha diverses tècniques per a provocar la precipitació o cristallització parcial fins a assolir un estat d’equilibri Atesa l’existència de factors dissolvent, pH, etc que permeten el manteniment de solucions sobresaturades o que provoquen, convenientment manipulades, llur precipitació, l’estudi de les dissolucions sobresaturades troba una gran aplicació en anàlisi química, tant gravimètrica com volumètrica coprecipitació, oclusió, precipitació, i en processos de cristallització, puix que la velocitat d’aquesta…
tipus primari
Química
Denominació d’algunes substàncies de les quals hom pot preparar dissolucions de concentració exactament coneguda.
Són emprades en anàlisi volumètrica volumetria per a valorar dissolucions d’altres reactius dels quals hom no pot preparar, per simple pesada i dissolució, solucions de concentració exactament coneguda Aquestes substàncies poden també ésser emprades per a valoracions directes Un tipus primari ha de complir les següents condicions ha d’ésser fàcilment assequible i purificable, tèrmicament estable a 100°C, i no ha d’absorbir humitat, ni reaccionar amb el diòxid de carboni ni l’oxigen Ha de presentar reaccions simples, ràpides i estequiomètriques i posseir un mètode adequat per a la…
eudiòmetre
Química
Instrument utilitzat en l’anàlisi volumètrica de certes mescles de gasos.
Consta d’una proveta graduada, de vidre gruixut, amb aixetes que tanquen tots dos extrems Quan cal determinar la composició d’una mescla de dos gasos coneguts, hom introdueix la mescla en l’eudiòmetre juntament amb un tercer gas adientment escollit, el qual, en saltar una guspira, es combina amb un dels components de la mescla Si el component resultant no és gasós, hom determina el volum del gas emprat, car és mesurable el volum residual total Hom empra també l' eudiòmetre de mercuri , l’extrem interior de la proveta del qual és introduït en una proveta de mercuri
bureta

Bureta automàtica
© Bürkle
Química
Instrument de mesura de volums de solucions emprat en anàlisi volumètrica.
En general és emprada per a mesurar el volum de solució valorada que hom ha d’addicionar a un pes o un volum definit de substància problema fins a assolir el punt final d’una valoració La bureta ordinària és un tub de vidre de diàmetre uniforme, graduat en millilitres i dècimes de millilitre, d’una cabuda total de 50 o de 25 ml, acabat a la part inferior en una clau de vidre o d’un polímer inatacable tefló i en una prolongació gairebé capillar, dita el bec de la bureta, per on raja la solució de reactiu Les buretes automàtiques o autoburetes introdueixen el líquid reactiu a flux constant o a…
Robert Wilhelm Bunsen
Química
Químic alemany.
Professor, successivament, de l’Escola Politècnica de Kassel i de les universitats de Marburg, Breslau i Heidelberg, destacà pels seus treballs sobre els composts de cacodil —que permeteren d’aprofundir el concepte de radical—, per la introducció de la pila de Bunsen pila i per un mètode d’isolament de metalls magnesi, alumini, sodi, bari, calci i liti per via electroquímica a partir dels clorurs fosos Posteriorment treballà amb Henry Enfield Roscoe en importants recerques en el camp de la fotometria desenvolupà el fotòmetre de taca de greix, i en collaboració amb Gustav Robert Kirchhoff, a…
amperometria
Química
Mètode d’anàlisi química derivat de la polarografia
, que consisteix essencialment en una tècnica instrumental objectiva per determinar el punt final de volumetries.
Hom mesura la variació de la intensitat del corrent de difusió polarogràfic en funció del volum de solució de reactiu valorant addicionat des d’una bureta les mesures són realitzades a un voltatge aplicat constant En general, hom utilitza un sol elèctrode polaritzable l’elèctrode de gotes de mercuri o un microelèctrode rotatori de platí, i hom obté corbes corresponents a casos en què la substància problema és electroactiva i el reactiu valorant no, el reactiu és electroactiu i el problema no, o són tots dos electroactius El mètode és aplicable a tots els tipus de volumetria, i especialment…
anàlisi conductomètrica
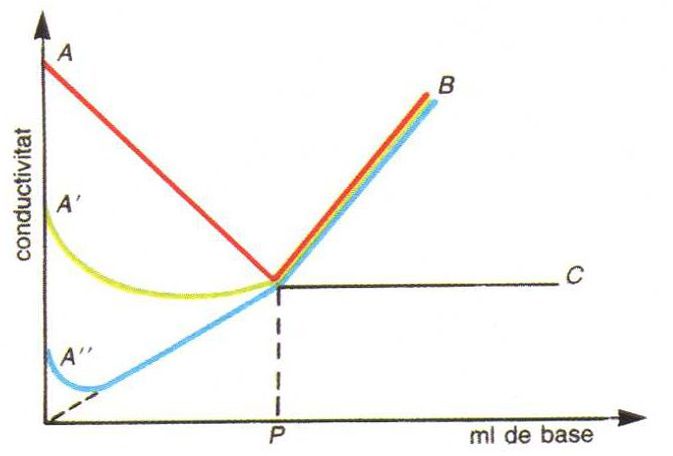
Valoració conductomètrica d’un àcid amb una base: corba AB, àcid fort amb una base forta; corba A'B, àcid mitjanament fort amb una base forta; corba A''B àcid feble amb una base feble; P, punt d’equivalència
©
Química
Procediment analític usat per a determinar el punt final de les volumetries, basat en la mesura de la variació de la conductivitat electrolítica de la solució problema deguda a l’addició de reactiu valorant.
Com que la conductivitat electrolítica depèn de la mobilitat dels ions presents en la solució i de llurs concentracions, l’addició d’un reactiu en provoca canvis importants sempre que doni lloc a la desaparició d’una espècie iònica de la solució sigui per formació d’un compost poc dissociat o d’una sal insoluble i a la seva substitució per quantitats equivalents d’un dels ions del reactiu de mobilitat diferent de la de l’espècie eliminada Així, hom pot dur a terme conductimètricament volumetries de neutralització, de precipitació i de formació de complexos, però només en casos favorables…