Resultats de la cerca
Es mostren 16 resultats
volum molar
Física
Volum ocupat per la molècula gram d’un gas.
Segons la llei d’Avogadro, per a unes determinades condicions de pressió i temperatura, el valor del volum molar és independent de la naturalesa del gas per a una pressió de 760 mm de mercuri i 0°C de temperatura el volum molar val 22,415 l
calor molar
Física
Energia que ha de rebre un mol d’una substància per tal que la seva temperatura s’elevi una unitat; és igual a la calor específica
multiplicada per un mol.
absortivitat molar
Física
Absortivitat, quan la concentració c és expressada en mols per litre.
adiabàtic | adiabàtica
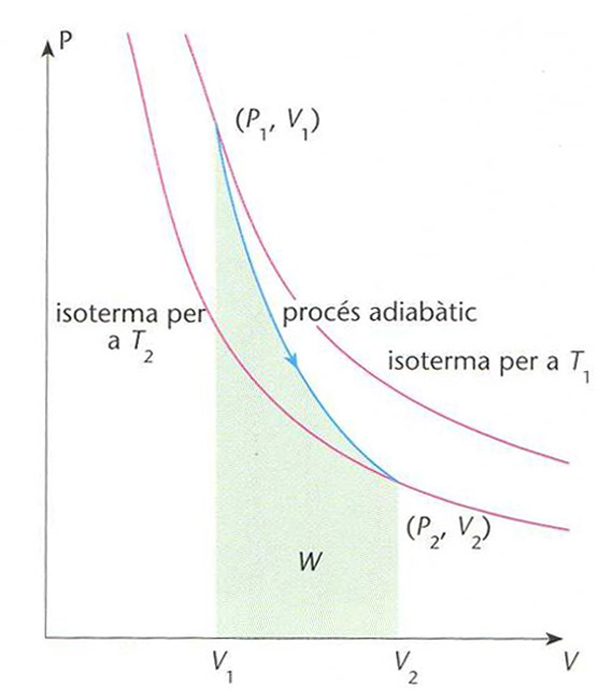
Comparació de l’evolució de la pressió P d’un gas ideal en funció del volum V, entre un procés adiabàtic (línia blava) i un d’isotèrmic (línies vermelles)
© fototeca.cat
Física
Dit del procés temodinàmic en el qual no hi ha intercanvi de calor entre el sistema considerat i l’exterior.
En un procés adiabàtic reversible l' entropia del sistema es manté constant Qualsevol compressió o expansió d’un fluid que es realitzi en un temps molt curt per exemple, expansió del vapor en una turbina pot ésser considerada adiabàtica En un gas ideal, un procés adiabàtic és regit per la relació p V γ =constant essent p , la pressió V , el volum, γ = C p /C v C p , la calor molar a pressió constant C v , la calor molar a volum constant mentre que per a un procés isotèrmic es compleix pV = constant
variable termodinàmica
Física
Cadascuna de les magnituds físiques mútuament compatibles l’especificació del valor de les quals determina un estat en el sistema termodinàmic considerat.
En el cas dels gasos ideals, hom empra la pressió, el volum i la temperatura absoluta, o sia p, V, T Les relacions matemàtiques entre les variables termodinàmiques o d’estat són anomenades equacions d’estat del sistema Per a un gas real, amb pressió crítica p c , temperatura crítica T c i volum molar crític V c , hom defineix les anomenades variables reduïdes mitjançant les relacions p r = p/p c T r = T/T c V r = V/V c , on p, T i V són, respectivament, la pressió, la temperatura i el volum molar en l’estat considerat L’equació d’estat dels gasos reals adopta la…
nombre de Loschmidt
Física
Nombre de molècules contingut en la unitat de volum d’un gas ideal en condicions normals de pressió i temperatura (760 mm de Hg i 0°C).
És relacionat amb el nombre d'Avogadro per mitjà del volum molar , i val 2,68719 × 10 2 5 m - 3
amagat
Física
Unitat de volum usada a vegades en termodinàmica.
És el volum molar d’un gas a 0°C i 1 atmosfera Rep el seu nom del físic Émile-Hilaire Amagat
coeficients del virial
Física
Cadascun dels coeficients, dependents de la temperatura, que apareixen en l’equació d’estat d’un gas real expressada com a sèrie de potències, i que són propis d’aquest gas.
Essent p la pressió, v el volum molar i l’equació d’estat, A , B , C , etc, són els anomenats coeficients del virial
coeficient osmòtic
Física
Química
Coeficient introduït per Bjerrum, que inclou tots els factors que expressen la desviació del comportament d’una solució respecte del comportament ideal.
D’aquesta forma, per un component i d’una barreja, el potencial químic s’expressa per μ i =μ o i + g i RT ln x i on g i és el coeficient osmòtic i x i és la fracció molar del solut en la dissolució
equació de Sackur-Tetrode
Física
Equació que permet el càlcul de l’entropia total de translació d’un gas monoatòmic a partir de la massa molecular, la temperatura i la pressió.
L’equació és expressada per S t = R ln 2π mkT 3 / 2 / h 3 V + 5/2 on S t és l’entropia molar total, N el nombre de molècules del gas, V el volum del receptacle del gas i m la massa de cada molècula L’entropia translacional d’un gas a temperatura normal és la contribució més important a l’entropia total del gas