Resultats de la cerca
Es mostren 92 resultats
alum de crom
Química
Alum constituït per sulfat doble de potassi i de crom hidratat.
Forma cristalls violats que donen solucions aquoses violades en fred, que esdevenen verdes en escalfar-les Hom l’obté reduint el dicromat potàssic en medi sulfúric És emprat com a mordent en tints, en l’adob al crom i en fotografia com a enduridor
fosfit
Química
Qualsevol sal o èster de l’àcid fosforós (H3PO3).
Pel fet d’ésser un àcid tribàsic, hom en coneix les sals monometàlliques, dimetàlliques i trimetàlliques L’ió fosfit PO 3 &≡sup té dos electrons lliures en l’àtom de fòsfor en dissolucions aquoses es produiria la reacció PO 3 &≡sup + H 2 O →HPO 3 = +OH -
bioestimulació
Ecologia
Mètode de bioremediació que es basa en la disminució del contaminant mitjançant l’estimulació del creixement i l’activitat d’agents biològics autòctons que degraden aquests contaminants.
En general, en la bioestimulació es proporcionen nutrients limitants del creixement dels agents biològics, com ara el nitrogen i el fòsfor En el cas dels sòls, es fan circular en forma de solucions aquoses S'ha utilitzat amb èxit per a bioremediar sòls contaminats amb gasolina, compostos orgànics volàtils i semivolàtils, i pesticides
Wilhelm Pfeffer
Biologia
Naturalista alemany.
Fou professor de botànica a Marburg, Bonn, Basilea i Tübingen S'especialitzà en embriologia i fisiologia vegetals Estudià i mesurà les pressions osmòtiques de les solucions aquoses, mitjançant unes membranes semipermeables, que són conegudes com a cèllules de Pfeffer Publicà Handbuch der Pflanzenphysiologie 1881 i Studien zur Energetik der Pflanze 1892, entre altres obres
oxoni
Química
Nom de l’ió H 3
O +
, derivat de la coordinació d’un protó sobre l’oxigen de l’aigua.
Existeix en les solucions aquoses dels àcids, fortament associat amb altres molècules d’aigua la vida mitjana d’un ió individual és de 10 - 1 3 s Té una estructura de piràmide triangular aplanada, amb un angle H-O-H de 115° El nom oxoni és emprat com a base per als seus productes de substitució
clorat
Química
Qualsevol sal de l’àcid clòric.
Comercialment, hom obté els principals clorats per electròlisi de les solucions aquoses dels respectius clorurs Tenen un potencial d’oxidació molt elevat relativa facilitat de donar clor i oxigen lliure Les barreges de clorats amb materials orgànics, metalls Al , Mg, As, CU, etc, carbó, fósfor, sofre, etc, són explosius potents, i hom els empra per a focs d’artifici i llumins
al·loxana
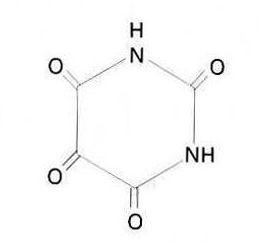
Al·loxana
©
Química
Compost heterocíclic.
Forma un tetrahidrat i un monohidrat anhidre, esdevé rosa a 230 °C i es fon a 256 °C És soluble en aigua, alcohol i acetona les solucions aquoses són àcides al tornassol, donen a la pell una coloració vermella i fan una olor desagradable És obtinguda per oxidació de l’àcid úric i és utilitzada en síntesi orgànica i en la investigació bioquímica, per a produir diabetis en animals experimentals
àcid sulfurós
Química
Oxoàcid del sofre, de fórmula H2SO3, en el qual el sofre ocorre en l’estat d’oxidació 4+.
No és conegut en estat lliure, i les solucions aquoses d’àcid sulfurós contenen en realitat hidrats del diòxid de sofre SO 2 Hom en coneix, però, nombroses sals sulfit És obtingut per dissolució del diòxid de sofre en l’aigua o hidrolitzant halogenurs de sulfinil Aquestes solucions es comporten com un àcid relativament fort pK 1 =1,8 pK 2 =7, presenten caràcter reductor i són tèrmicament inestables i alliberen SO 2 per ebullició
wolframat
Química
Denominació genèrica dels anions poliatòmics que tenen el tungstè com a àtom central i de les sals que contenen aquests anions.
Els wolframats més ben coneguts són els de fórmula general M 1 ₃WO₄, que hom obté per dissolució del triòxid de tungstè WO₃ en solucions aquoses d’hidròxids alcalins i que, mitjançant reaccions metatètiques, permeten la preparació dels wolframats dels altres metalls En solució, existeixen com a ions discrets WO₄ 2- , tetraèdrics, i no gaudeixen de les propietats oxidants dels cromats D’altra banda, l’acidificació suau de solucions de wolframats condueix a la formació de polianions
àcid barbitúric
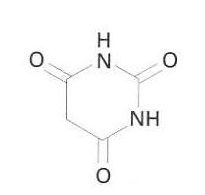
Àcid barbitúric
Farmàcia
Química
Ureid cíclic de l’àcid malònic.
Forma un dihidrat que es fon a 245°C amb una mica de descomposició és soluble en èter, no tant en aigua i alcohol Les solucions aquoses són àcides És obtingut per la condensació de l’èster malònic amb urea catalitzada per l’etòxid sòdic La substitució dels dos àtoms d’hidrogen en posició 5 per diversos grups dóna lloc a tota una gamma de productes farmacèutics barbiturat És emprat també com a catalitzador de polimerització i en la indústria de colorants