Resultats de la cerca
Es mostren 12 resultats
Johannes Nicolaus Brønsted
Física
Fisicoquímic danès.
Professor de química de la Universitat de Copenhaguen i director de l’institut fisicoquímic d’aquesta universitat Es distingí per treballs de recerca sobre catàlisi, propietats dels ions, cinètica química i, sobretot, juntament amb Thomas Martin Lowry, en l’enunciat de la teoria àcid-base , que porta llur nom àcid de Brønsted-Lowry , base de Brønsted-Lowry
base de Brønsted i Lowry
Química
Qualsevol substància acceptora d’ions hidrogen o protons independentment de quina sigui la seva càrrega elèctrica i el dissolvent que la conté.
àcid de Brønsted i Lowry
Química
Qualsevol substància donadora d’ions hidrogen o protons independentment de quina sigui la seva càrrega elèctrica i el dissolvent que la conté.
superàcid
Química
Nom genèric de certs àcids amb un índex d’acidesa milions de vegades més gran que el del sulfúric.
Hom els obté, generalment, barrejant un àcid de Lewis i un àcid de Brønsted en medi anhidre
àcid
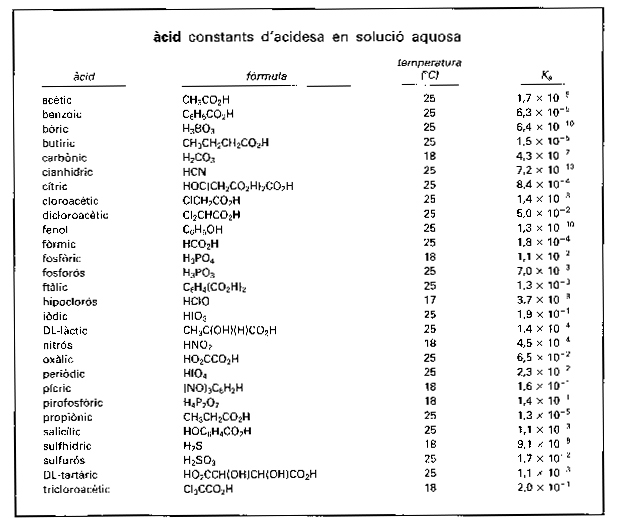
Constants d’acidesa en solució aquosa
Química
Cada una de les substàncies caracteritzades químicament pel fet de provocar canvis de color en les substàncies anomenades indicadors i de reaccionar molt ràpidament amb les substàncies d’un altre grup anomenades bases.
Les propietats típiques d’ambdós reactius desapareixen pel fet de la reacció, cosa que és interpretada com una neutralització mútua dels àcids i de les bases que dóna composts neutres tals com, per exemple, les sals Aquestes dues propietats essencials van acompanyades, en general, d’altres de menys fonamentals i no sempre presents, com el sabor àcid, l’activitat catalítica i la propietat —en solució aquosa— de dissoldre certes substàncies insolubles com els carbonats i molts metalls A més, els àcids i les bases poden desplaçar-se mútuament de llurs composts correlativament a llurs forces El…
funció d’acidesa
Química
Funció de l’acidesa a H S +
de les solucions d’un àcid en el solvent S, que dóna, per a cada composició de la solució, la tendència a cedir protons a una base.
Aquesta funció, introduïda per Hammett, és definida, per a una base de Brønsted elèctricament neutra B, per l’expressió on a i és l’activitat i f i el coeficient d’activitat de i f i = a i /C i , essent C i la concentració de i i pot ésser calculada per la fórmula on tant K A , que és la constant d’acidesa en el solvent S de l’àcid HB + , conjugat de B, com C B , i C H B + , que són concentracions, són experimentalment accessibles Si hom pot admetre tal com féu Hammett, basant-se en fets experimentals, que f B / f H B + depèn només de la càrrega elèctrica de B però no de la…
base
Química
Cadascuna de les substàncies caracteritzades químicament per les següents propietats:.
provocar el canvi de color o el viratge de determinades substàncies orgàniques, anomenades indicadors , o bé regenerar llur color primitiu quan aquest ha estat alterat prèviament pels àcids, i donar amb els àcids reaccions de neutralització en què es perden les propietats característiques d’ambdues classes de substàncies i es formen sals Trets organolèptics menys generals de les bases són llur sabor amarg i llur tacte untuós El concepte de base s’ha desenvolupat parallelament al d' àcid La primera teoria moderna que intentà de relacionar les propietats àcides o bàsiques amb la composició…
acidocatalitzat | acidocatalitzada
Química
Dit de les reaccions químiques catalitzades per àcids, siguin aquests de Brønsted o de Lewis.
hidràcid
Química
Nom genèric dels àcids de Brønsted que no tenen els protons enllaçats per mitjà d’àtoms d’oxigen.
Són el resultat de la combinació dels elements més electronegatius amb l’hidrogen Donen hidràcids els halògens, el sofre, el seleni i el telluri Hom els anomena mitjançant el sufix - hídric HCl, clorhídric H 2 S, sulfhídric, etc En condicions normals són gasos incolors molt solubles en aigua