Resultats de la cerca
Es mostren 8 resultats
alcalimetria
Química
Part de la volumetria
que inclou els mètodes d’anàlisi de substàncies àcides per valoració amb una solució d’una base de concentració coneguda.
En general, les solucions bàsiques emprades són bases fortes, en particular els hidròxids de sodi, de potassi o de bari, totes les quals han d’ésser protegides del contacte amb l’atmosfera, ja que absorbeixen el diòxid de carboni, la qual cosa fa que minvi amb el temps llur concentració en base lliure És aconsellable, en conseqüència, de procedir sovint a la determinació d’aquesta per valoració amb un tipus primari de caràcter àcid, com el ftalat àcid de potassi, l’àcid benzoic, l’àcid sulfàmic o el iodat àcid de potassi Com en el cas de l'acidimetria, els mètodes alcalimètrics es fonamenten…
índex d’àcid
Química
Nombre de mil·ligrams d’hidròxid de potassi necessaris per a neutralitzar l’acidesa lliure d’un gram d’oli, greix o resina.
En una resina, l’índex d’àcid és una característica intrínseca en un oli o en un greix indica el grau d’alteració La determinació és feta per alcalimetria
aurina
Química
Colorant groc del grup del trifenilmetà.
Forma cristalls de llustre verd metàllic fàcilment polvoritzables, insolubles en aigua, benzè i èter, solubles en alcohol És emprat com a indicador en alcalimetria i vira de color entre pH 6,8 groc i 8,2 vermell
Carl Friedrich Mohr
Química
Químic alemany.
Estudià farmàcia a les universitats de Berlín i Bonn i fou professor a la Universitat de Bonn 1867-79 Féu importants treballs d’anàlisi volumètrica, introduí l’ús de l’àcid oxàlic en alcalimetria i ideà la balança de Mohr per a determinar pesos específics de líquids i sòlids
àcid sulfamídic
Química
Monoamida de l’àcid sulfúric, de fórmula H2NSO3H.
Es presenta en forma de pólvores cristallines blanques, estables a la humitat, que es fonen a 205°C És poc soluble en aigua, però es troba fortament ionitzat en dissolució Les seves sals són molt solubles en aigua Té aplicació en la neteja de metalls, en anàlisi química com a estàndard per a alcalimetria, en síntesi orgànica, com a agent estabilitzant del clor i els hipoclorits i com a blanquejant del paper i les fibres tèxtils
acidesa
Química
Indicació quantitativa de les propietats àcides.
L’acidesa d’un àcid HA en un solvent amfipròtic S, o sigui, la seva força en aquest solvent, ve mesurada per la seva tendència a cedir un protó al solvent, és a dir, per la constant d’acidesa K A expressió on a i és l’activitat de l’espècie i i K és la constant de l’equilibri HA + S ⇌ HS + + A - La força d’un àcid depèn, doncs, del solvent En general, resulta còmode d’expressar l’acidesa en unitats logarítmiques, i per obtenir nombres positius hom pren el logaritme de la inversa de K A , que és representat pel símbol pK A pK A = - log K A Com més elevada és l’acidesa, és a dir, com més…
acidimetria
Química
Part de la volumetria
que comprèn els mètodes d’anàlisi de substàncies de caràcter bàsic per valoració amb una solució d’un àcid de concentració coneguda.
Els mètodes de l’acidimetria són fonamentats en reaccions de neutralització , quan és una base lliure la que hom valora amb la solució àcida, o de desplaçament , quan la substància valorada és una sal d’un àcid molt dèbil i l’agent valorant un àcid fort Hom calcula la quantitat de substància bàsica problema a partir del volum d’agent valorant àcid necessari perquè la reacció arribi a ésser completa, moment que la solució assoleix un valor específic del pH Hom posa de manifest aquest moment mitjançant l’ús d’alguns dels indicadors de neutralització , substàncies orgàniques àcides o bàsiques…
àcid
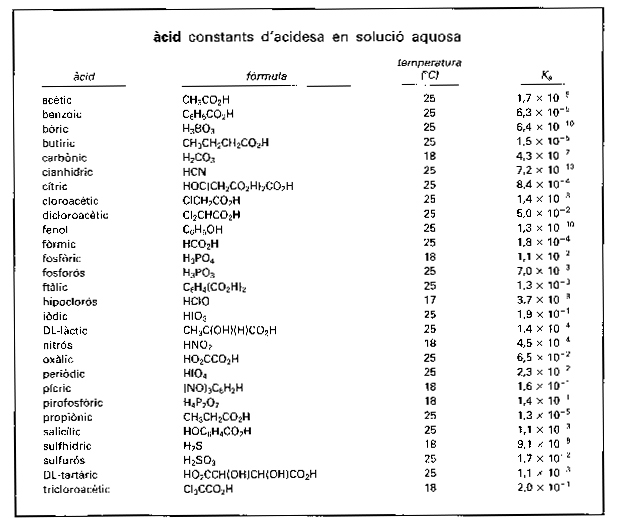
Constants d’acidesa en solució aquosa
Química
Cada una de les substàncies caracteritzades químicament pel fet de provocar canvis de color en les substàncies anomenades indicadors i de reaccionar molt ràpidament amb les substàncies d’un altre grup anomenades bases.
Les propietats típiques d’ambdós reactius desapareixen pel fet de la reacció, cosa que és interpretada com una neutralització mútua dels àcids i de les bases que dóna composts neutres tals com, per exemple, les sals Aquestes dues propietats essencials van acompanyades, en general, d’altres de menys fonamentals i no sempre presents, com el sabor àcid, l’activitat catalítica i la propietat —en solució aquosa— de dissoldre certes substàncies insolubles com els carbonats i molts metalls A més, els àcids i les bases poden desplaçar-se mútuament de llurs composts correlativament a llurs forces El…