Resultats de la cerca
Es mostren 8 resultats
termoquímica
Química
Denominació clàssica de la part de la termodinàmica que tracta de la mesura i de la interpretació dels canvis calorífics que acompanyen canvis d’estat o reaccions químiques.
Essencialment, consisteix en l’aplicació als sistemes químics del principi de la conservació de l’energia primer principi de la termodinàmica Des del punt de vista termoquímic, una reacció és exotèrmica quan té lloc amb alliberament de calor, i endotèrmica quan cal fornir-li calor perquè evolucioni Atès que l’energia interna d’un sistema és una funció d’estat, la mesura de les calors de reacció serà, sempre que no s’exerceixi cap treball positiu o negatiu, una mesura de la variació energètica del procés considerat Aquesta condició s’acompleix en els processos desenvolupats a volum constant,…
Germain Henri Hess
Química
Químic rus, d’origen suís.
Fundador de la termoquímica, fou professor de química a la Universitat de Peterburg Treballà fonamentalment en la química dels gasos i enuncià la llei que duu el seu nom
Julius Thomsen
Química
Químic danès.
Efectuà nombroses mesures calorimètriques, estudià la llei d’acció de massa 1867 i el comportament dels àcids, dels quals mesurà la força Féu estudis de termoquímica i predigué l’existència d’un grup de gasos inactius
Thomas Andrews
Física
Físic i químic irlandès.
Estudià química a Glasgow i a París i medicina a Edimburg Exercí la medicina a Belfast i des del 1845 fins al 1879 fou professor de química al Queen's College Treballà en la liqüefacció dels gasos i en definí els conceptes de temperatura i pressió crítiques, i també en termoquímica
caloria
Física
Unitat de quantitat de calor, desaconsellada pel SI.
Fou originàriament definida com la quantitat de calor necessària per a augmentar la temperatura d’un gram d’aigua destillada de 14,5°C a 15,5°C, a la pressió atmosfèrica normal constant D’acord amb el principi de conservació de l’energia, hom prefereix de definir-la en unitats de treball Així, hom ha definit la caloria termoquímica , 1 cal t h =4,184 J 1948, la caloria a 15°C o caloria, pròpiament, 1 cal 1 5 =4,185 5 J 1950 i la caloria de les taules internacionals, o caloria IT , 1 cal I T =4,186 8 J 1956 Té com a múltiples la gran caloria o quilocaloria , 1 kcal=10 3 cal, i la…
termodinàmica química
Física
Química
Branca de la termodinàmica dedicada a l’estudi general de les relacions entre l’energia i els processos químics que forneix una base teòrica per a la racionalització dels diversos capítols de la química on són presos en consideració els bescanvis d’energia.
Comprèn la termoquímica, en l’estudi de la qual hom fa ús de les funcions termodinàmiques, energia interna i entalpia l'estàtica química, on entren en joc les funcions derivades del segon principi de la termodinàmica, principalment l’entropia i l’entalpia lliure de Gibbs i una part important de l'electroquímica, que és sistematitzada emprant aquesta darrera funció, equivalent al treball útil que hom pot obtenir d’una reacció química, a pressió i temperatura constants Aquestes funcions termodinàmiques es relacionen amb les equacions d’estat dels sistemes materials, establertes a partir de…
term-
Forma prefixada del mot grec thermós, que significa 'calent' i que indica relació amb la calor o amb la temperatura (ex.: termalgèsia, termoquímica, termòmetre).
reacció
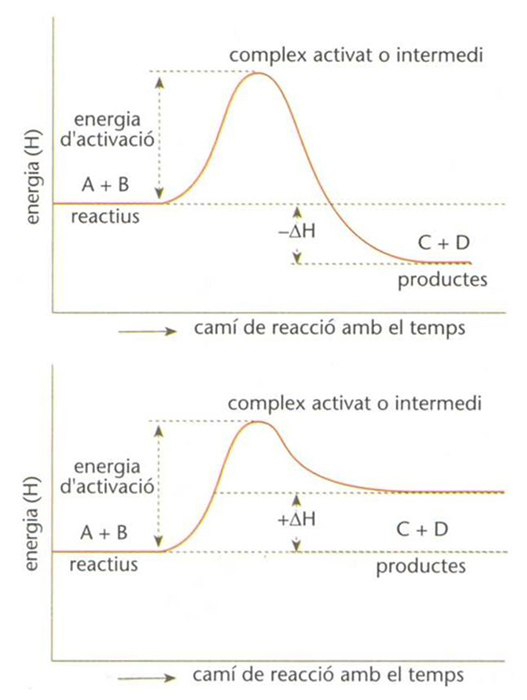
Diagrames entàlpics de dues reaccions directes, una d’exotèrmica (a dalt) i una d’endotèrmica (a baix): l’energia de reacció, mesurada per la variació de l’entalpia ∆H, és negativa en el primer cas i positiva en el segon
© Fototeca.cat
Química
Cadascun dels processos mitjançant els quals una o més substàncies, simples o compostes, es transformen en unes altres.
Són excloses d’aquesta definició aquelles transformacions nuclears en les quals un element es converteix en un altre reacció nuclear Des del punt de vista del nombre de passos implicats, les reaccions són classificades en elementals, quan transcorren en un sol pas, i complexes En un sentit microscòpic, la reacció elemental és un procés químicament irreduïble, en el qual ocorre un canvi concertat, mitjançant el qual es passa directament d’un estat estacionari a un altre, sense la intervenció de cap intermedi D’altra banda, les reaccions complexes poden sempre descompondre's en una successió de…