Fases i interfases: De la química a la pandèmia
-
- Home
-
- 3 of 22
El concepte de fase és multidisciplinari. Parlen de fases els físics, els químics, els astrònoms, els epidemiòlegs, els economistes, els biòlegs, els geòlegs, els metges... Però, què és una fase?
Els diccionaris generals no ens ajuden a aclarir-ho. Al diccionari de l'Institut d'Estudis Catalans (DIEC) o al diccionari de la Real Academia Española (DLE) hi ha definicions genèriques, i després definicions del concepte aplicables a cada àmbit d'especialització, definicions que normalment són incomprensibles si no estàs entrat en el llenguatge de l'àmbit corresponent. Mirem la definició genèrica de l'IEC: una fase és un "estat pel qual passa un procés, una cosa o un ésser viu, en el curs del seu desenvolupament". La definició de la RAE és "cada uno de los distintos estados sucesivos de un fenómeno natural o histórico, o de una doctrina, negocio, etc.". Crida l'atenció que a ambdues definicions hi aparegui el terme estat, i que es consideri que el concepte de fase s'aplica a un procés evolutiu.
Analitzem breument el concepte de fase als sistemes fisicoquímics, i comparem-lo amb el concepte de fase que el govern d'Espanya ha impulsat en la desescalada de la pandèmia. En fisicoquímica fase no és sinònim d'estat. De fet, aquest és un tema que dona per moltes lliçons a classe. Per resumir-lo, seguirem els textos sagrats i intentarem entendre'ls. Segons la Unió Internacional de Química Pura i Aplicada (IUPAC), organisme que reuneix totes les societats químiques del món i que té, entre molts altres serveis, recopilacions de nomenclatura, una fase és "una entitat d'un sistema material uniforme pel que fa a la composició química i a l'estat físic". La IUPAC no defineix què és un estat físic, però aquest és un concepte comú genèric que es refereix als coneguts estats clàssics sòlid, líquid i gas, i també a l'estat plasma —no considerarem aquí altres estats de la matèria, com el condensat de Bose-Einstein, el condensat de Fermi, ni les estrelles de neutrons. Aquests són tipus d'estats més complexos, però que potser són més senzills d'entendre que les fases de desconfinament.
Sòlid, líquid i gas són estats senzills de visualitzar i de propietats ben conegudes, però podem pensar si no hi ha també altres estats intermedis, com les espumes, les pastes, les emulsions, els cristalls líquids o els gels. I sí, des del punt de vista macroscòpic aquests sistemes tenen propietats intermèdies entre sòlids i líquids, però és perquè totes aquestes matèries són constituïdes per dues o més substàncies barrejades on cadascuna és una fase diferent. Per exemple, la llet és una emulsió en la qual hi ha —simplifiquem moltíssim— dos líquids diferents: una dissolució d'aigua amb lactosa, i, disperses per allà, gotetes del greix de la llet. És, doncs, un líquid, la llet, format per dues substàncies separades, cadascuna de les quals també en estat líquid, i que són dues fases diferents: la fase aquosa —una dissolució— i la fase greixosa —una barreja de triglicèrids del greix de la llet. En resum, la llet està en estat líquid però no és una fase líquida. Les mateixes distincions podríem fer a la maionesa, a les pintures o a molts cosmètics.
Ara ens complicarem la vida.
Se sol considerar que dues fases juxtaposades estan separades per una interfície (en anglès, interface), que és una superfície ideal de separació i que té dues dimensions. El castellà no accepta per ara el terme intercara, tot i que és molt usat, i accepta només interfaz, però restringit a sistemes electrònics, i el fa derivar d'interface. Aquest concepte d'interfície o superfície ideal matemàtica de separació és acceptada per la RAE però donant-li el nom d'interfase, i la fa derivar —sorpresa— de l'anglès interphase, no d'interface. En català interfase s'accepta, però només per referir-se a una fase intermèdia en la vida de la cèl·lula durant la qual no està en divisió.
En resum, per ara: en català, dues fases estan idealment separades per una interfície, i en castellà les separa una interfase-superfície matemàtica (en anglès, una interface). Però encara ho complicarem més. Fins aquí, la descripció elemental, que no té en compte l'estructura íntima de la matèria. Però podem descriure la matèria amb una visió més detallada.
Si ens apropem a escala microscòpica a la zona de separació entre dues fases, aquesta discontinuïtat que creiem veure entre un líquid i un gas, per exemple, no és tal. Seguint els principis de la teoria atomicomolecular, la separació no és una superfície matemàtica bidimensional, sinó una regió tridimensional de més o menys gruix, on les propietats varien progressivament d'una zona a l'altra. La densitat, per exemple, va variant des d'una zona molt densa de molècules —el líquid— a una zona molt menys densa —el gas—. Entre el líquid i el gas hi ha una regió d'un gruix mesurable, de propietats diferents de les del líquid i del gas: és una fase intermèdia en 3D o interfase (en anglès, interphase, interfacial layer o interfacial region). Ni en català ni en castellà existeix aquest terme, però en català podem dir-ne impunement interfase; en castellà seria ambigu, perquè el terme interfase es referiria simultàniament a una superfície matemàtica i a una fase intermèdia d'un cert volum. Caldria que inventessin un terme nou.
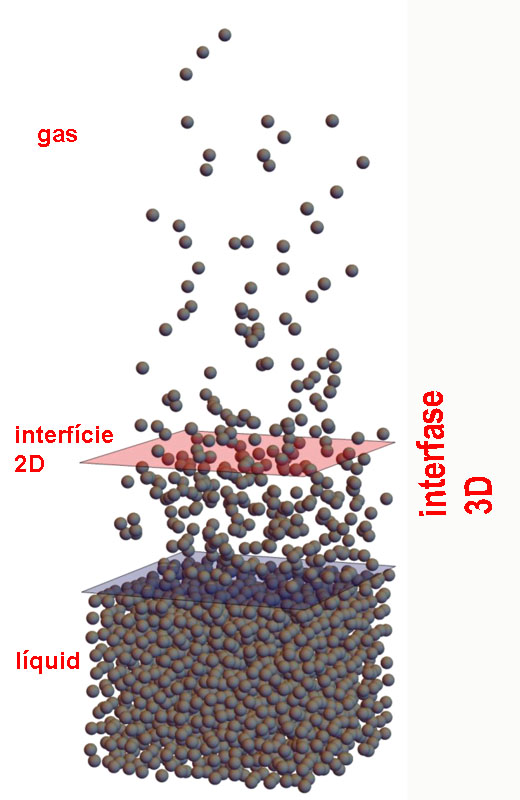 |
| A la figura, visió atomicomolecular de la separació entre un líquid i un gas. Hi ha una zona tridimensional amb menys concentració de molècules que el líquid i més que el gas: és la interfase. La interfície seria un pla matemàtic situat al mig de la interfase. |
Anem ja a la desescalada o desconfinament.
El BOE defineix les fases del procés de desconfinament, i atribueix propietats específiques a cadascuna: densitat, o distància entre persones; temps en què es poden posar en contacte els diferents individus; distància a la qual es poden desplaçar, etc.
Les fases 0 i 1 gairebé definien una fase sòlida: immobilitat, distàncies a recórrer mínimes, cap volatilitat (no poder sortir a l'exterior), etc. La fase 2 és una mica líquida: es pot sortir controladament, es poden recórrer distàncies més llargues, la interacció entre individus pot ser més gran i més freqüent, etc. I a la fase 3 gairebé estem parlant de gasos —no ideals—: mobilitat superior, contactes més freqüents, anar gairebé on vulguis, grups més nombrosos, etc.
Les fases fisicoquímiques genuïnes són o l'una o altra: o líquid o gas. En canvi, les fases del desconfinament són menys definides, i per això a Catalunya en algunes zones es van inventar la fase 1,5 de desconfinament, i ara s'ha parlat de la fase 2,5 (o d'excepcions a la fase 2). Són situacions que, estrictament parlant, no són ortodoxes segons el BOE, però s'inventen per tal de superar les limitacions de les definicions rígides. S'han inventat així les interfases socials, situacions entre una fase i una altra, de propietats intermèdies, menys rígides que la fase anterior i no tan flexibles com la fase posterior.
Les analogies arriben fins on poden. En química una fase té una composició uniforme: en l'exemple de la llet, cadascuna de les gotetes disperses de greix és de la mateixa composició química que una altra. En canvi, en una mateixa zona geogràfica del desconfinament —per exemple, la regió de Barcelona en fase 2— hi ha situacions ben diferents, perquè no és el mateix un barri del centre de Barcelona que un poblet petit del Garraf. Són diferents els tipus d'habitatge, l'entorn i la proximitat d'espais naturals, com també la densitat de vehicles o la relació dels veïns amb el seu ajuntament o amb l'escola. I a més, hi ha el diferent comportament dels individus. N'hi ha que bruscament passen de sòlid —confinats a casa— a gas —esport, anar-se'n lluny, platja, terrassa de bar—,
mentre que d'altres ho fan molt més gradualment. En canvi, al món de la química totes les molècules són iguals i es comporten de la mateixa manera.
Mirem les fases de la Lluna, que són lluna nova, quart creixent, lluna plena i quart minvant. La Lluna va girant sense pausa, canviant contínuament d'aspecte. Atribuïm el concepte de quart creixent a tots els moments que la Lluna té forma aproximada de D, i quart minvant quan té forma de C (ja sabem des de petits que la Lluna és una mentidera). Doncs bé, el desconfinament s'ha assemblat més a les fases de la Lluna que a les fases fisicoquímiques. Hi ha hagut en molts casos una evolució constant, és a dir, que dintre d'una mateixa fase s'han donat, per part de la població, comportaments variats i variables progressivament alliberats. Les autoritats intenten mantenir el capteniment de la població de la fase corresponent amb un mínim de rigor: barreres, vigilants, portes tancades, distància social, mascaretes, cues organitzades i altres controls. Però amb poc èxit. N'hi ha prou amb sortir al carrer per constatar-ho. Certa gent té comportaments que depassen les normes, i a la pràctica fan impunement el que volen. Això, una molècula mai no ho faria!
Foto de capçalera: Josiah Willard Gibbs, fundador de la termodinàmica química.