Resultats de la cerca
Es mostren 12 resultats
nitrogen
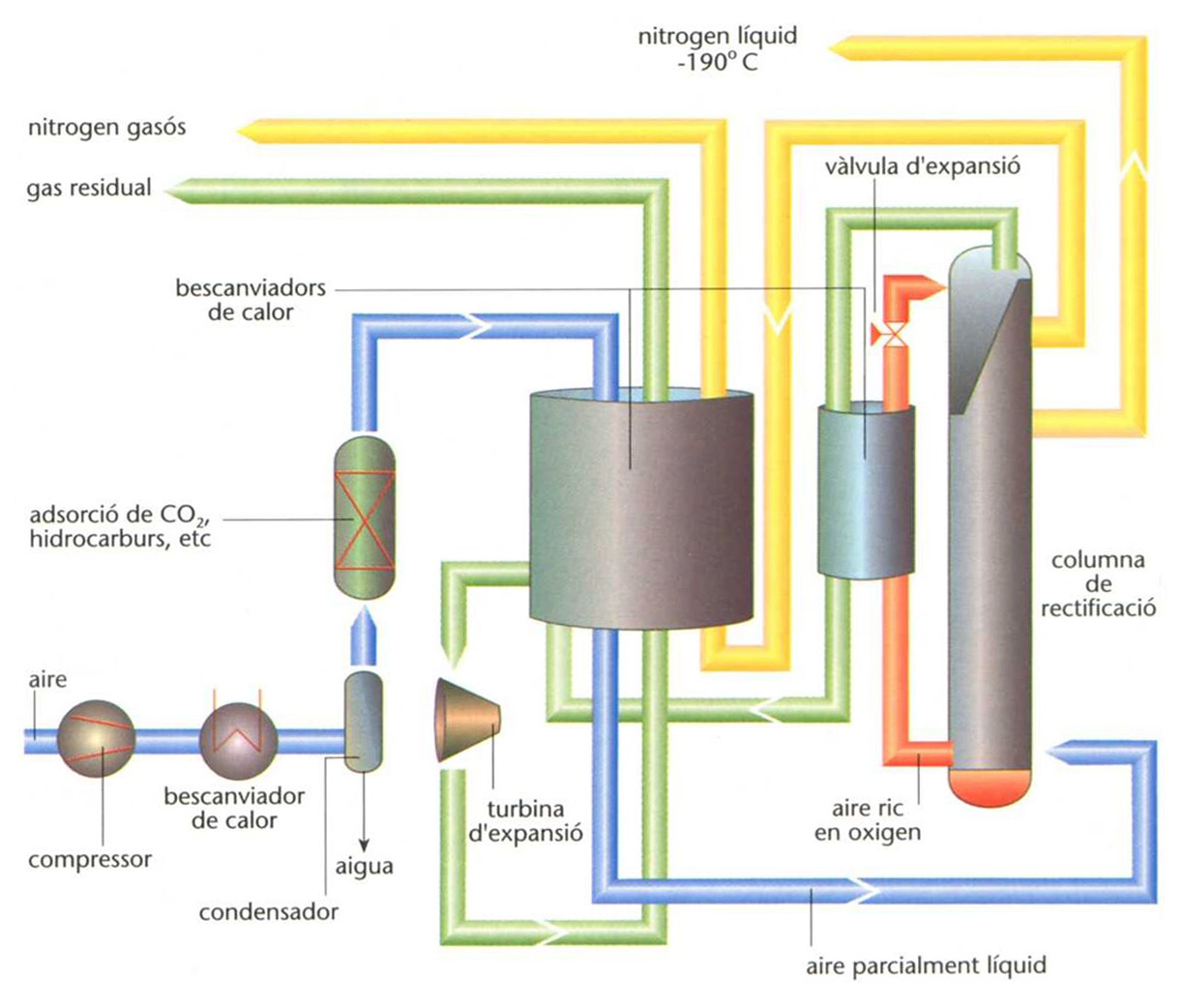
Diagrama de flux del procediment d’obtenció del nitrogen a partir de l’aire líquid en tres etapes: depuració de l’aire gasós (consideració de l’aigua i adsorció d’impureses amb matisos moleculars de zeolites), condensació parcial de l’aire (refrigeració a baixa temperatura en un bescanviador de calor) i destil·lació fraccionada a una pressió de 0,6-1 MPa (columna de rectificació); l’expansió del gas residual (turbina) és la font de condensació
© Fototeca.cat
Química
Element químic no metàl·lic pertanyent al grup VA de la taula periòdica, situat entre el carboni i l’oxigen.
És un gas incolor, inodor i insípid, i és l’element més lleuger del grup Fou descobert per D Rutherford el 1772, i a la mateixa època, també per H Cavendish i J Priestley El nitrogen natural és format pels isòtops naturals 14 N i 15 N i pels isòtops radioactius 12 N, 13 N, 16 N i 17 N En estat natural el nitrogen molecular, a la temperatura ambient, és un gas que constitueix una gran part de l’atmosfera l’aire sec en conté un 78,09% en volum En estat combinat és un dels principals constituents de les proteïnes animals i vegetals i d’un gran nombre de substàncies orgàniques El nitrat de Xile…
substituent
Química
Denominació genèrica de qualsevol àtom o grup que reemplaça un àtom d’hidrogen d’un compost fonamental.
En la pràctica, la consideració d’un àtom o grup com a substituent és condicionada per l’elecció de cadena principal o de compost fonamental que hom efectua d’acord amb les regles de la IUPAC
regles de Fajans
Química
Regles qualitatives donades per Fajans el 1923 que indiquen que, en un conjunt de substàncies químicament similars amb enllaç fonamentalment iònic, el caràcter covalent augmenta en els següents casos: amb la càrrega dels ions, quan el catió és petit i l’anió és gros i quan el catió té una configuració electrònica que no és la d’un gas noble.
Les regles de Fajans deriven de la consideració de la polaritzabilitat i del poder polaritzant dels ions, car el caràcter parcialment covalent de l’enllaç prové sobretot de la polarització de l’anió, que augmenta la densitat electrònica entre els nuclis
funció d’acidesa
Química
Funció de l’acidesa a H S +
de les solucions d’un àcid en el solvent S, que dóna, per a cada composició de la solució, la tendència a cedir protons a una base.
Aquesta funció, introduïda per Hammett, és definida, per a una base de Brønsted elèctricament neutra B, per l’expressió on a i és l’activitat i f i el coeficient d’activitat de i f i = a i /C i , essent C i la concentració de i i pot ésser calculada per la fórmula on tant K A , que és la constant d’acidesa en el solvent S de l’àcid HB + , conjugat de B, com C B , i C H B + , que són concentracions, són experimentalment accessibles Si hom pot admetre tal com féu Hammett, basant-se en fets experimentals, que f B / f H B + depèn només de la càrrega elèctrica de B però no de la seva natura…
Kary B. Mullis
Química
Químic nord-americà.
Estudià a l’Institut de Tecnologia de Geòrgia i a la Universitat de Califòrnia a Berkeley, on es doctorà el 1972 Després de dur a terme recerca en diverses universitats, l’any 1979 s’incorporà a Cetus Corp, una empresa de biotecnologia on el 1983 desenvolupà la seva aportació principal, la reacció en cadena de la polimerasa PCR, descobriment que revolucionà la biologia molecular, la biomedicina i la biotecnologia, ja que permet fer un gran nombre de còpies de segments d’ADN de manera ràpida i notablement acurada Aquesta tècnica ha tingut aplicacions tan diverses com el diagnòstic de…
termoquímica
Química
Denominació clàssica de la part de la termodinàmica que tracta de la mesura i de la interpretació dels canvis calorífics que acompanyen canvis d’estat o reaccions químiques.
Essencialment, consisteix en l’aplicació als sistemes químics del principi de la conservació de l’energia primer principi de la termodinàmica Des del punt de vista termoquímic, una reacció és exotèrmica quan té lloc amb alliberament de calor, i endotèrmica quan cal fornir-li calor perquè evolucioni Atès que l’energia interna d’un sistema és una funció d’estat, la mesura de les calors de reacció serà, sempre que no s’exerceixi cap treball positiu o negatiu, una mesura de la variació energètica del procés considerat Aquesta condició s’acompleix en els processos desenvolupats a volum constant,…
activitat
Química
Relació entre la fugacitat
( f
) d’una substància en un determinat estat i la seva fugacitat ( f°
) en un estat de referència arbitrari: a = f/f°
.
L’activitat a és una quantitat adimensional de valors arbitraris per tal com depèn d’una tria arbitrària, igual a la unitat en l’estat de referència De la definició de fugacitat hom dedueix que G—G° = nRT lna G i G° essent els valors de l’energia lliure de Gibbs en l’estat considerat i en el de referència, respectivament Per a servir-se de les activitats, cal escollir i precisar bé, en cada cas, l’estat de referència Per als gasos, la convenció més còmoda és prendre com a tal, a cada temperatura, l’estat en què f ° = 1 d’on a = f De la definició de fugacitat hom dedueix aleshores que, per…
dissociació iònica
Química
Reacció d’equilibri entre una substància en solució i els seus ions.
Segons Svante Arrhenius 1887, les propietats especials de les solucions de tots els electròlits són explicades acceptant que s’hi dóna una fracció de l’electròlit dissociada en ions en equilibri amb la forma molecular no dissociada, equilibri que compleix les lleis generals de les reaccions reversibles Així, hom pot definir una constant de dissociació, determinada a partir del grau de dissociació fracció dissociada, el qual depèn de la concentració i que hom pot avaluar experimentalment a partir de mesures de la conductivitat elèctrica o dels valors de les propietats colligatives La teoria d’…
termodinàmica química
Física
Química
Branca de la termodinàmica dedicada a l’estudi general de les relacions entre l’energia i els processos químics que forneix una base teòrica per a la racionalització dels diversos capítols de la química on són presos en consideració els bescanvis d’energia.
Comprèn la termoquímica, en l’estudi de la qual hom fa ús de les funcions termodinàmiques, energia interna i entalpia l'estàtica química, on entren en joc les funcions derivades del segon principi de la termodinàmica, principalment l’entropia i l’entalpia lliure de Gibbs i una part important de l'electroquímica, que és sistematitzada emprant aquesta darrera funció, equivalent al treball útil que hom pot obtenir d’una reacció química, a pressió i temperatura constants Aquestes funcions termodinàmiques es relacionen amb les equacions d’estat dels sistemes materials, establertes a…
destil·lació

Destil·lació fraccionada amb columna de plats
© Fototeca.cat
Química
Operació de separació, total o parcial, dels constituents d’una mescla líquida segons llur diferent pressió de vapor.
Hom basa la destillació en el fet que el vapor en equilibri amb el líquid és, en general, més ric en el constituent més volàtil És una operació molt corrent i important, tant al laboratori com a la indústria, que consisteix a vaporitzar parcialment la mescla en general fent-la bullir i condensar els vapors, recollint el condensat separadament del residu Hom pot fer la condensació directament, evitant qualsevol retrogradació destillació simple , o bé després d’haver obtingut per condensació parcial dels vapors, és a dir, per rectificació, llur progressiu enriquiment en el constituent més…