Resultats de la cerca
Es mostren 15 resultats
afinitat electrònica
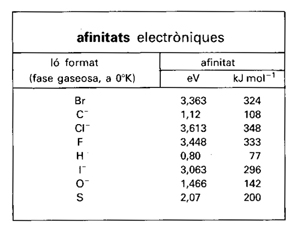
Afinitats electròniques
Química
Tendència que manifesta un àtom a guanyar electrons, mesurada per l’energia E de la reacció:
Les afinitats electròniques poden, en certs casos, ésser mesurades i, per als halògens, poden ésser deduïdes de les energies reticulars dels cristalls iònics dels halurs alcalins Les dels metalls, positives o feblement negatives
forces de van der Waals
Química
Denominació genèrica de les forces, diferents de les que condueixen a l’enllaç químic, existents entre àtoms, entre molècules o entre àtoms i molècules.
Llur existència, postulada per JDvan der Waals l’any 1873, permeté un estudi sistemàtic de les propietats físiques dels líquids i dels gasos equació de van der Waals Conceptualment, sovint és difícil de distingir-les d’altres interaccions enllaçants, bé que, energèticament, són molt diferents Així, mentre que l’enllaç químic té energies de l’ordre de l’electronvolt, les forces de van der Waals tenen associades energies de l’ordre dels 10- 3 eV Quan hom les representa en funció de la distància interatòmica o intermolecular, donen lloc a gràfics del tipus Per a…
activació
Química
Excitació d’una molècula que incrementa la seva energia fins al nivell en què esdevé químicament reactiva o emet radiació electromagnètica.
La manera més freqüent de produir aquesta excitació és l' activació tèrmica L’elevació de temperatura augmenta d’acord amb la funció de distribució la proporció de molècules amb energies de translació elevades, que poden reaccionar per efecte d’una collisió amb un altre reactant, o en les quals els moviments intramoleculars assoleixen una amplitud suficient per a donar lloc a una reorganització interna L’activació pot també produir-se ja sigui per absorció de fotons de llum visible o ultraviolada, ja sigui per efecte de les radiacions emeses per les substàncies radioactives o…
Institut Català d’Investigació Química
Química
Fundació privada impulsada per la Generalitat de Catalunya amb l’objectiu de convertir-se en referent per a la química en l’Espai Europeu d’Investigació.
Situat en el nucli del que ha d’ésser el Parc Científic i Tecnològic de Tarragona, inaugurà una primera fase l’any 2003 amb 8 012 m 2 de superfície construïda i fou ampliat en 4 800 m 2 l’any 2009 L’edifici, estructurat de forma modular i sota criteris de sostenibilitat que minimitzen el consum d’aigua i energia, disposa de 27 laboratoris de recerca, 3 de suport a la recerca i 4 laboratoris tecnològics, tots a càrrec de personal altament especialitzat A més, hi ha un laboratori dedicat a la Ressonància Magnètica Nuclear, un clúster d’ordinadors, un laboratori per a reaccions a pressió i un…
enllaç de retrodonació
Química
Model teòric per a la interpretació de l’enllaç entre àtoms metàl·lics pesants de transició i molècules neutres, com ara el monòxid de carboni o una olefina.
En el cas d’una unió de tipus sigma σ entre el metall i la molècula, els orbitals n-1 d del metall tenen energies similars a les dels orbitals ns i np de la capa de valència i, per tant, poden participar en la formació d’enllaços Així, l’enllaç resultant pot considerar-se com a suma d’un enllaç sigma σ, originat per donació d’un parell electrònic no compartit del lligand a un orbital d buit i de simetria adient del metall, i d’una cessió de càrrega d’un orbital d ocupat del metall a un orbital antienllaçant π* desocupat del lligand neutre En el cas d’una unió de tipus pi π,…
fugacitat
Física
Química
Funció termodinàmica que substitueix la pressió parcial en les equacions que tracten de descriure el comportament dels gasos reals.
Si G 1 i G 2 són les energies lliures normals d’un gas a dues pressions p 1 i p 2 , les fugacitats f 1 i f 2 del gas a aquestes pressions són definides de forma que es compleixi l’equació G 2 — G 1 = nRT ln f 2 / f 1 Comparant aquesta equació amb l’equació dels gasos ideals G 2 — G 1 = nRT ln p 2 / p 1 , hom veu que, per al comportament ideal, la fugacitat és proporcional a la pressió contràriament, per al comportament no ideal la fugacitat no coincideix amb la pressió corresponent La fugacitat pot ésser determinada per l’equació RT ln f/p = v — RT /p dp , on v = V/ n és el…
adsorció
Química
Procés d’equilibri consistent en l’adhesió dels àtoms o molècules d’un material ( adsorbat
) damunt la superfície d’un altre ( adsorbent
), és a dir, en llur concentració a la interfície a causa del camp de forces residuals existent a la superfície dels sòlids i dels líquids.
L’adsorció constitueix un fenomen de la més gran importància per la seva intervenció en els processos vitals, en les reaccions catalítiques i, àdhuc, en certes hipòtesis cosmogòniques, en la formació de l’univers Fou constatada experimentalment per Fontana 1777, i Kayser proposà el terme 1881 Segons les seves característiques energètiques i cinètiques són definits dos tipus d’adsorció l’adsorció física i l’adsorció química L' adsorció física presenta energies d’enllaç petites tipus forces de Van der Waals amb valors entre 2 i 6 kcal/mol És ràpida, i fàcilment reversible L’…
dissolució
Química
Procés pel qual una substància (el solut) es dispersa en una altra substància (el dissolvent) i dóna un sistema homogeni anomenat solució
.
Aquest procés de dispersió del solut té lloc segons un o uns quants dels mecanismes següents per reacció química amb el dissolvent, formant una nova substància, per reacció química amb el dissolvent, formant un solvat , i per dispersió simple El primer cas es dóna quan el dissolvent interacciona el solut trencant alguns enllaços i formant noves substàncies com en la dissolució dels metalls en àcids, formant sals, o en la dels anhídrids en aigua, formant àcids El segon cas implica també reacció, la de solvatació anomenada, en les solucions aquoses, hidratació , que dóna solvats constituïts per…
fotoquímica
Química
Part de la química que té per objecte l’estudi de la interacció entre un fotó ( quàntum
de llum) i una molècula, amb els canvis físics i químics que en resulten.
A diferència de les reaccions tèrmiques que transcorren entre molècules en llurs estats electrònics fonamentals tot i que llurs energies de vibració, de rotació i de translació són en els marges alts d’una distribució de Maxwell-Boltzman, les reaccions fotoquímiques tenen lloc en molècules en llurs estats electrònics excitats, que són obtinguts per absorció d’un fotó En fotoquímica interessen els fotons de longitud d’ona λ entre 200 i 800 nm, per dues raons en primer lloc, perquè el contingut energètic d’aquests fotons equival a la diferència d’energies que hi ha…
orbital molecular
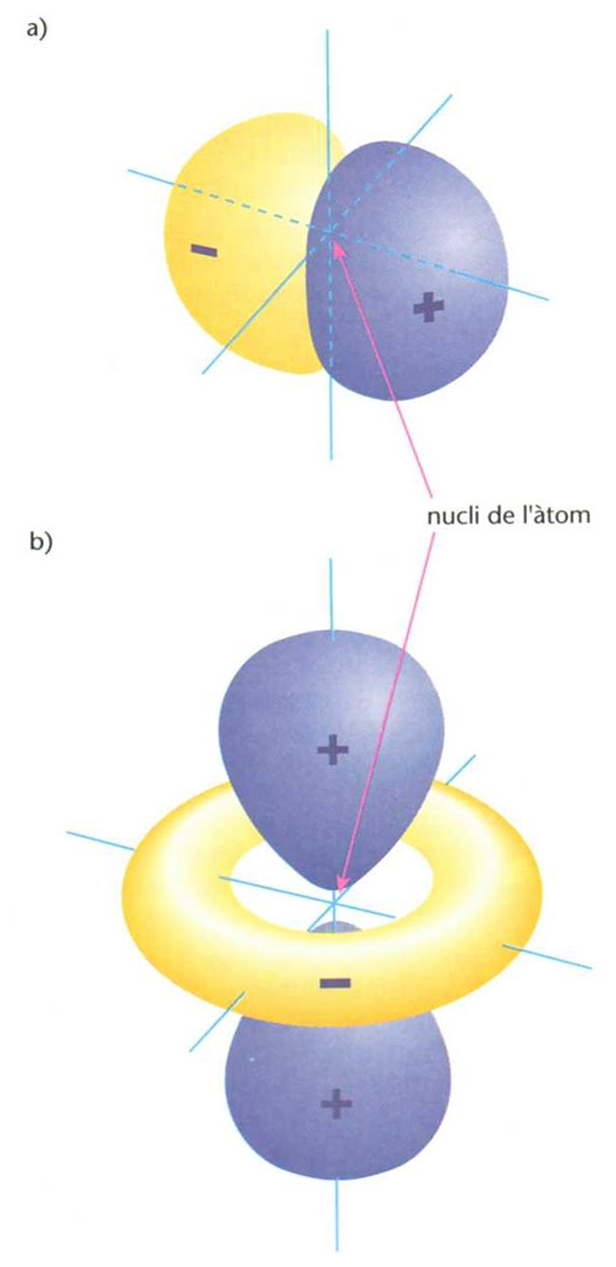
Representació tridimensional de dos orbitals (de nombres quàntics n=2,l = 1 (p) i m=1(a), i n =3,l = 2 (d) i m = 0 (b)) de l’àtom d’hidrogen en prèsencia de camp magnètic extern: assenyalen dos estats energètics de l’electró i la regió al voltant del nucli on és més probable de trobar l’electró en cadascun d’aquests dos estats (els valors de l i m determinen les dimensions, la forma i l’orentació de l’orbital): els caolors respresenten els signes + o - que pren la funció d’ona
© Fototeca.cat
Química
Cadascuna de les funcions d’ona, solució de l’equació de Schrödinger, associades a un electró que forma part d’una molècula.
Presenten les mateixes característiques matemàtiques que els orbitals atòmics Són de natura policèntrica i constitueixen en ells mateixos una interpretació de l’enllaç químic La descripció de l’estructura molecular mitjançant l’ús d’orbitals moleculars és coneguda com a teoria de l’enllaç dels orbitals moleculars , i consisteix a considerar inicialment la molècula com un conjunt de nuclis amb ordenació pròpia, determinar els diversos orbitals de nuclis i omplir els orbitals multicèntrics així obtinguts amb els electrons de la molècula, mitjançant un procediment anàleg al seguit per a establir…