Resultats de la cerca
Es mostren 44 resultats
aluminat
Química
Nom genèric de les sals que deriven formalment de l’hidròxid alumínic considerat com un àcid feble.
Bé que és conegut l’ortoaluminat de calci 3CaOAl 2 O 3 , els aluminats alcalins que són solubles en aigua són, tant a l’estat sòlid com en solució, metaaluminats, de fórmula general MAlO 2 , i hom pot obtenir-los per reacció de l’hidròxid alumínic amb una molècula de base Llurs solucions, fortament alcalines per hidròlisi, són descompostes àdhuc per un àcid tan feble com el carbònic Els aluminats poden ésser també preparats per fusió d’una mescla d’òxid metàllic i d’alúmina Diversos minerals del grup de les espinelles espinella, crisoberil, etc són també metaaluminats de fórmula…
solució amortidora
Química
Solució el pH de la qual es modifica molt poc per dilució o per addició de quantitats moderades d’àcids o de bases, àdhuc forts.
Les solucions amortidores, dites també solucions tampó , deuen llurs propietats a la presència d’un sistema amortidor constituït, en general, per una mescla d’un àcid feble i una de les seves sals, o d’una base feble i una de les seves sals, o de dues sals estadis successius de la neutralització d’un poliàcid Escollint convenientment l’àcid o la base i les concentracions relatives, és possible d’obtenir solucions amortidores per a qualsevol valor del pH La magnitud de l’efecte amortidor és molt considerable L’addició de 10 ml de solució normal d’àcid fort a un litre…
hidròlisi
Química
Descomposició d’una substància química per l’acció de l’aigua.
Per hidròlisi, l’aigua reacciona amb els cations per a produir bases febles, i amb els anions per a donar àcids febles La sal d’un àcid feble i d’una base forta, la d’una base feble i d’un àcid fort i la d’un àcid i una base febles tenen tendència a hidrolitzar-se El grau d’hidròlisi és la relació entre el nombre de mols hidrolitzats i el nombre total de mols de sal En el cas de la reacció d’hidròlisi de l’ió acetat, CH 3 COO - + H 2 O ⇌CH e - COOH + OH - , la constant de dissociació és donada per l’equació K e essent la constant de dissociació de l’aigua i K a la constant de dissociació de l…
glioxal
Química
Dialdehid obtingut a partir de l’acetaldehid per oxidació amb àcid nítric o diòxid de seleni.
El polímer anhidre passa a monòmer per escalfament La seva dissolució aquosa conté diversos oligòmers hidratats i reacciona com un àcid feble
àcid hipofosfòric
Química
Àcid tetrabàsic feble format per oxidació lenta del fòsfor en l’aire.
A temperatura elevada es descompon en els àcids fosforós i metafosfòric H 4 P 2 O 6 →H 3 PO 3 + HPO 3
àcid carbònic
Química
Àcid que resulta de la combinació del diòxid de carboni amb l’aigua.
Es comporta com a àcid feble amb dues etapes de dissociació que corresponen a dues sèries de sals, els hidrogenocarbonats o carbonats àcids, com el bicarbonat de sodi NaHCO 3 i els carbonats neutres, com el carbonat de sodi Na 2 CO 3
desmineralització
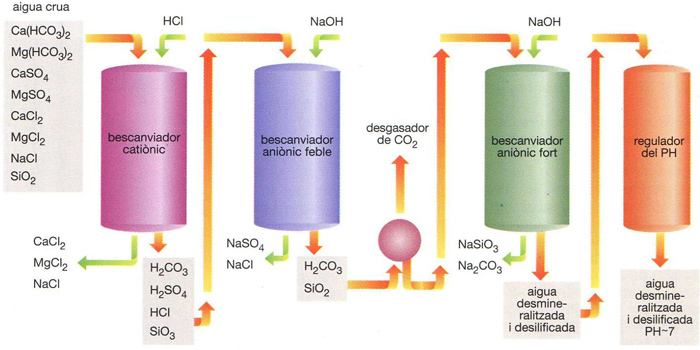
Diagrama de cadena de desmineralització
© Fototeca.cat
Química
Operació per la qual hom obté, a partir d’aigua crua i mitjançant resines de bescanvi iònic
o electrodiàlisi
, una aigua lliure de sals.
Una cadena completa de desmineralització per bescanvi consta d’un bescanviador catiònic, d’un d’aniònic feble, d’un desgasador i d’un bescanviador aniònic fort si cal, hom fa que acabi amb un regulador de pH Si hom vol obtenir una aigua gairebé químicament pura, hi afegeix un bescanviador mixt catiònic + aniònic
àcid fenol
Química
Compost orgànic que té almenys una funció àcid carboxílic i una funció fenol.
La força dels àcids fenols depèn de la posició relativa de les dues funcions En el cas dels àcids hidroxibenzoics que són els àcids fenols més simples, l’isòmer orto àcid salicílic és molt més fort que l’àcid benzoic, l’isòmer meta lleugerament més fort i l’isòmer para lleugerament més feble Aquest comportament complex és explicat per l’acció combinada dels efectes inductiu i mesomèric, i per la formació d’un enllaç hidrogen en l’àcid salicílic
aminofenazona
Farmàcia
Química
Compost orgànic de fórmula:
Pólvores cristallines, amargues, solubles en aigua calenta i en dissolvents orgànics Té caràcter de base feble i es fon a 107-109°C És preparada a partir de l’antipirina per nitrosació, reducció del grup nitroso a amina i metilació És molt emprada com a antipirètic, antireumàtic i analgèsic bé que tenyeix l’orina d’un color vermellós, és ben tolerada per l’organisme humà És coneguda també per amidopirina o pel nom comercial i registrat de Piramidon
pK
Química
En els àcids i les bases, operador definit per l’expressió pK = -logK, essent K la constant d’equilibri de la reacció d’un àcid (pKa) o una base (pKb) amb un solvent amfipròtic.
El pK és una mesura de la força dels àcids i de les bases i és relacionat amb la variació d’energia lliure ∆G de la reacció amb el solvent, d’acord amb l’equació En medi aquós, hom pot relacionar el pK b d’una base amb el pK a del seu àcid conjugat mitjançant el valor del producte iònic de l’aigua K w , segons pK a + pK b = pK w , a qualsevol temperatura En aquestes condicions, un valor petit de pK a indica un àcid fort o una base feble acidesa