Resultats de la cerca
Es mostren 29 resultats
forces de van der Waals
Química
Denominació genèrica de les forces, diferents de les que condueixen a l’enllaç químic, existents entre àtoms, entre molècules o entre àtoms i molècules.
Llur existència, postulada per JDvan der Waals l’any 1873, permeté un estudi sistemàtic de les propietats físiques dels líquids i dels gasos equació de van der Waals Conceptualment, sovint és difícil de distingir-les d’altres interaccions enllaçants, bé que, energèticament, són molt diferents Així, mentre que l’enllaç químic té energies de l’ordre de l’electronvolt, les forces de van der Waals tenen associades energies de l’ordre dels 10- 3 eV Quan hom les representa en funció de la distància interatòmica o intermolecular, donen lloc a gràfics del tipus Per a distàncies…
adhesió
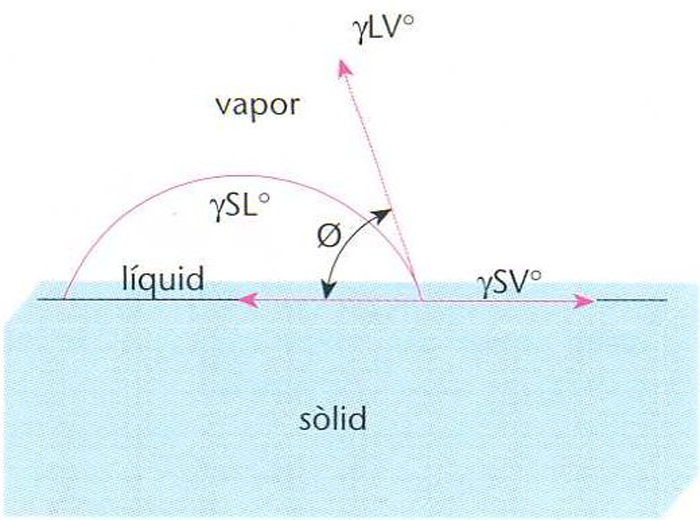
Angle de contacte ϑ en l’adhesió entre sòlid i líquid
© fototeca.cat
Química
Fenomen per mitjà del qual dues superfícies són mantingudes juntes per forces intermoleculars.
L’adhesió pot ésser mecànica, electroestàtica o per atracció molecular, segons que la seva dependència sigui funció, respectivament, d’una interacció mecànica, d’una atracció de càrregues elèctriques o d’una força de valències Des del punt de vista termodinàmic presenta dos punts que defineixen el sistema les condicions necessàries per a establir el contacte interfacial o mullabilitat les condicions necessàries per a dur a terme aquest contacte, l’adhesió, que controla la força d’adhesió Les condicions termodinàmiques de mullament i estesa d’un líquid sobre un sòlid es basen en l’angle de…
solvatació
Química
En una solució, fenomen consistent en la interacció de solvents polars amb ions o molècules de solut mitjançant forces atractives ió-dipol o dipol-dipol.
Com a resultat d’aquestes interaccions, cada ió o molècula de solut es troba voltat d’un cert nombre de molècules orientades de solvent, el qual nombre pot ésser avaluat mitjançant un índex de solvatació , que representa la mitjana de molècules que l’envolten La capa de molècules més pròxima al solut i que, en el cas d’un ió, l’acompanya en la seva migració en un camp elèctric és anomenada capa de solvatació química , mentre que les capes més allunyades, unides per forces més dèbils i parcialment desordenades, són les de solvatació física en el cas particular en què el solvent és…
teoria de Stern
Química
La més completa de les teories de la doble capa elèctrica, enunciada per O. Stern l’any 1924 i que combina el concepte de doble capa rígida de Helmholtz amb el de la capa difusa de Gouy i Chapman.
La teoria de Stern és basada en la suposició que la distribució d’ions ha d’ésser fortament influïda per les forces existents entre aquests ions i la superfície que hom considera i, atesa la ràpida disminució amb la distància d’aquestes forces, prediu la formació d’una monocapa d’ions fortament adherida a la superfície considerada, així com l’existència d’una capa difusa D’aquesta manera, el potencial total general a la interfase ψ o , pot ésser expressat per ψ o = ψ r + ψ d , essent ψ r la caiguda de potencial de la capa rígida i ψ d la de la capa difusa
adsorció
Química
Procés d’equilibri consistent en l’adhesió dels àtoms o molècules d’un material ( adsorbat
) damunt la superfície d’un altre ( adsorbent
), és a dir, en llur concentració a la interfície a causa del camp de forces residuals existent a la superfície dels sòlids i dels líquids.
L’adsorció constitueix un fenomen de la més gran importància per la seva intervenció en els processos vitals, en les reaccions catalítiques i, àdhuc, en certes hipòtesis cosmogòniques, en la formació de l’univers Fou constatada experimentalment per Fontana 1777, i Kayser proposà el terme 1881 Segons les seves característiques energètiques i cinètiques són definits dos tipus d’adsorció l’adsorció física i l’adsorció química L' adsorció física presenta energies d’enllaç petites tipus forces de Van der Waals amb valors entre 2 i 6 kcal/mol És ràpida, i fàcilment reversible L’adsorció química…
dissociació iònica
Química
Reacció d’equilibri entre una substància en solució i els seus ions.
Segons Svante Arrhenius 1887, les propietats especials de les solucions de tots els electròlits són explicades acceptant que s’hi dóna una fracció de l’electròlit dissociada en ions en equilibri amb la forma molecular no dissociada, equilibri que compleix les lleis generals de les reaccions reversibles Així, hom pot definir una constant de dissociació, determinada a partir del grau de dissociació fracció dissociada, el qual depèn de la concentració i que hom pot avaluar experimentalment a partir de mesures de la conductivitat elèctrica o dels valors de les propietats colligatives La teoria d’…
radi de van der Waals
Química
Pel que fa als cristalls moleculars d’elements no metàl·lics o de llurs composts covalents, valor definit per a cada element com la meitat de la distància d’equilibri entre els dos àtoms més pròxims d’aquest no enllaçats entre ells.
Els radis de van der Waals són una conseqüència de les forces intermoleculars d’atracció i repulsió forces de van der Waals i hom els pot considerar com una mesura de la distància mínima a la qual poden apropar-se dos àtoms sense establir un enllaç covalent La determinació experimental d’aquests radis és realitzada mitjançant la difracció de raigs X, i llur valor presenta una oscillació de ±0,05 Å, segons el compost en el qual han estat determinats Els valors numèrics dels radis de van der Waals s’aproximen als dels corresponents radis iònics dels mateixos elements…
enllaç
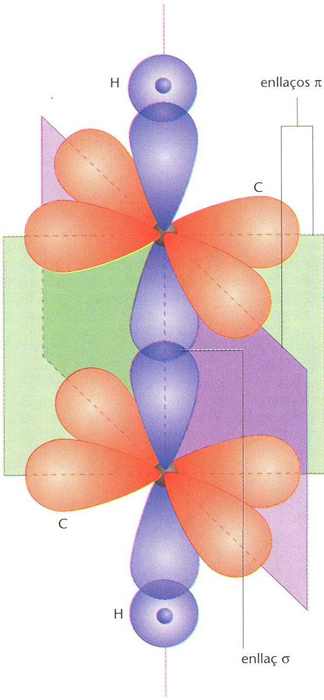
Superposició d’un enllaç δ i dos enllaços π amb plans nodals perpendiculars, en una molècula d’etí o acetilè (CH ≡CH)
© Fototeca.cat
Química
Interacció entre dos o més àtoms el resultat de la qual és la formació d’un compost, és a dir, d’un agregat que és estable dins un cert interval de temperatures i pressions.
La natura de les forces que donen lloc a l’enllaç químic fou objecte de moltes especulacions ja Demòcrit suposava que els àtoms eren ganxuts, però restà forçosament desconeguda fins a l’establiment de la constitució de l’àtom Ben abans, JJ Berzelius i S Arrhenius pressentiren, tanmateix, que es tractava de forces elèctriques Actualment hom sap que l’enllaç resulta de les forces de Coulomb entre les càrregues elèctriques positives i negatives del nucli i els electrons La petitesa de la massa dels constituents atòmics, i en especial de l’electró, fa que…
adamsita
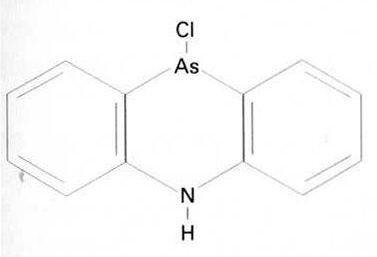
Adamsita
©
Química
Agent agressiu químic.
És un sòlid de color groc canari, molt venenós, irritant de la pell i de les vies respiratòries, insoluble en aigua obtingut escalfant difenilamina amb triclorur d’arsènic Les forces de policia l’utilitzen en forma de fum i sovint barrejat amb gasos lacrimògens per a dispersar manifestacions Provoca secreció nasal, tos i esternuts, dolors, mareigs i vòmits, depressió i feblesa Els seus efectes persisteixen un cert temps, però normalment no tenen conseqüències posteriors El punt de fusió és a 195ºC, i el d’ebullició a 410ºC
elastòmer dielèctric
Química
Elastòmer capaç de transformar el corrent elèctric en força mecànica.
Collocat entre dos elèctrodes s’expandeix o s’encongeix en la direcció del camp elèctric i en funció de la seva intensitat Aquest moviment imita perfectament el dels músculs dels éssers vius i pot desenvolupar forces més elevades, per la qual cosa els elastòmers dielèctrics resulten molt adequats en la fabricació d’implants i pròtesis musculars, però, també, en la de braços robòtics i, en general, la de dispositius miniaturitzats Els més utilitzats són els basats en el polimetacrilat de metil, o PMMA Els elastòmers dielèctrics constitueixen una de les famílies dels considerats…