Resultats de la cerca
Es mostren 11 resultats
afinitat
Química
Tendència d’una mescla de substàncies a reaccionar químicament, que ve mesurada per la disminució de l’energia lliure de Gibbs que la reacció, a temperatura i a pressió constants, provoca.
Històricament, bé que el mot havia estat utilitzat en un sentit similar des de més antic Albert Magne, la noció d’afinitat és a dir, d’‘inclinació’ mútua de les substàncies que reaccionen fou introduïda per tal d’explicar els fenòmens químics al segle XVIII, i popularitzada especialment per Boerhaave Per als químics de l’època, l’afinitat era la força desconeguda que provocava i mantenia la unió dels àtoms, i durant molts anys un gran esforç especulatiu fou fet per identificar-la Primerament, seguint el suggeriment de Newton, hom considerà que era una manifestació més de les forces de…
estàtica química
Química
Part de la química que estudia els estats d’equilibri al qual tendeixen els sistemes que experimenten una reacció reversible.
Hom anomena reversibles les reaccions que poden progressar en un sentit o en el sentit invers, i arriben en ambdós casos a un mateix estat d'equilibri químic, que és caracteritzat pels valors de les concentracions dels productes de la reacció i de les substàncies reaccionants que encara hi resten presents, i és modificat conformement a les lleis de JW Gibbs i HL Le Chatelier quan hom altera diverses variables, com les concentracions inicials, les pressions parcials o totals i la temperatura L’estudi quantitatiu de l’estàtica química es desenvolupà a partir de la llei d’acció de…
equació
Química
Representació, mitjançant símbols químics, dels canvis dels àtoms i de les molècules dels elements que intervenen en una reacció química.
El primer membre de l’equació representa les substàncies que entren en reacció, anomenades reactants , i el segon, els productes de la reacció, separats tots dos membres per una sageta → i la reacció és irreversible, o per dues sagetes ⇌ si és reversible Cadascun dels components de l’equació va acompanyat d’un coeficient estequiomètric que fixa la proporció en què els components entren en la reacció Així, per exemple N 2 + 3H 2 ⇌2NH 3 Bé que l’equació química no dóna informació sobre la cinètica de la reacció en l’aspecte energètic, hom pot indicar les variacions d’entalpia, d’energia lliure…
termodinàmica química
Física
Química
Branca de la termodinàmica dedicada a l’estudi general de les relacions entre l’energia i els processos químics que forneix una base teòrica per a la racionalització dels diversos capítols de la química on són presos en consideració els bescanvis d’energia.
Comprèn la termoquímica, en l’estudi de la qual hom fa ús de les funcions termodinàmiques, energia interna i entalpia l'estàtica química, on entren en joc les funcions derivades del segon principi de la termodinàmica, principalment l’entropia i l’entalpia lliure de Gibbs i una part important de l'electroquímica, que és sistematitzada emprant aquesta darrera funció, equivalent al treball útil que hom pot obtenir d’una reacció química, a pressió i temperatura constants Aquestes funcions termodinàmiques es relacionen amb les equacions d’estat dels sistemes materials, establertes a…
equilibri químic
Química
Estat d’un sistema químic (d’una reacció química) en el qual la velocitat de la formació dels productes a partir dels elements reactants és igual a la velocitat de desaparició d’aquells productes per a formar novament els elements inicials de la reacció.
Així, malgrat l’aparent estabilitat del sistema deguda a la invariabilitat de la concentració dels productes presents en la reacció, l’equilibri químic és un equilibri dinàmic, puix que el pas dels reactants a productes resultants, i viceversa, és constant Hom relaciona les activitats activitat i les concentracions dels productes de la reacció amb les dels reactants per mitjà de la llei d’acció de massa acció, que defineix la constant d’equilibri del sistema per a unes determinades condicions de pressió i de temperatura, amb la qual hom determina la composició del sistema en equilibri La…
activitat
Química
Relació entre la fugacitat
( f
) d’una substància en un determinat estat i la seva fugacitat ( f°
) en un estat de referència arbitrari: a = f/f°
.
L’activitat a és una quantitat adimensional de valors arbitraris per tal com depèn d’una tria arbitrària, igual a la unitat en l’estat de referència De la definició de fugacitat hom dedueix que G—G° = nRT lna G i G° essent els valors de l’energia lliure de Gibbs en l’estat considerat i en el de referència, respectivament Per a servir-se de les activitats, cal escollir i precisar bé, en cada cas, l’estat de referència Per als gasos, la convenció més còmoda és prendre com a tal, a cada temperatura, l’estat en què f ° = 1 d’on a = f De la definició de fugacitat hom dedueix…
potencial termodinàmic
Química
Nom donat a l’energia lliure de Gibbs d’un sistema termodinàmic G = H-TS, essent H l’entalpia, T la temperatura absoluta i S l’entropia del sistema.
química física
Química
Ciència de natura interdisciplinària que pot ésser formalment considerada com una branca de la química i que estudia, des d’una perspectiva física, els fenòmens químics o d’interès per a la química.
L’objectiu fonamental de la química física és d’arribar a conèixer els fonaments teòrics dels fenòmens químics i les lleis que els regeixen La química física pot abordar els seus problemes tant des del nivell macroscòpic o fenomenològic com des del microscòpic o molecular L’eina de treball emprada en l’estudi fenomenològic és la termodinàmica, mentre que la mecànica i principalment la mecànica quàntica proporcionen el mètode per a abordar els problemes microscòpics El buit existent entre aquests dos nivells pot ésser omplert mitjançant l’ús de la termodinàmica estadística, la qual permet,…
fase
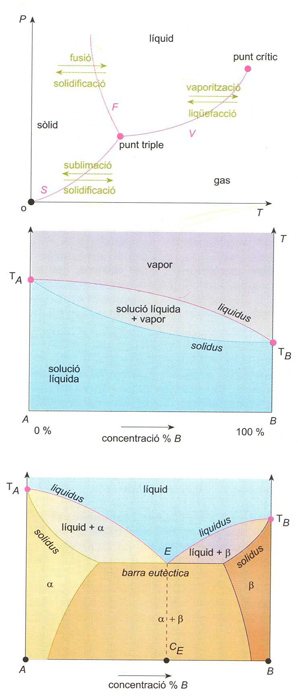
Diagrama de fases: (a) d’un sistema d’un sol component (F, corba de fusió; S, corba de sublimació; V, corba de vaporització); (b) d’un sistema binari líquid-vapor (TA i TB. punts d’ebullició d’A i B); (c) d’un sistema binari solid-líquid eutèctic (TA i TB. punts de fusió d’A i B); E punt eutèctic; CE, composició eutèctica: α i β són les dues fases sòlides que es presenten
© Fototeca.cat
Física
Química
Part d’un sistema, formada per un nombre qualsevol de components, homogènia i amb uns límits ben determinats que la separen de les altres parts del sistema i de la resta de l’univers.
La noció de fase generalitza la d’estat físic sòlid, líquid, gasós i permet distincions més subtils, com la que hi ha entre dues formes de cristallització d’un sòlid Els components d’un sistema són les substàncies que l’integren, i els constituents són les diferents fases que el formen Si només hi ha una fase, el sistema és homogeni , i si n’hi ha més, heterogeni El pas de la fase sòlida a la líquida és anomenat fusió , el de la líquida a la gasosa, vaporització , i el de la sòlida a la gasosa, sublimació Aquests canvis de fase són progressius , i els canvis en sentit contrari són anomenats…
energia
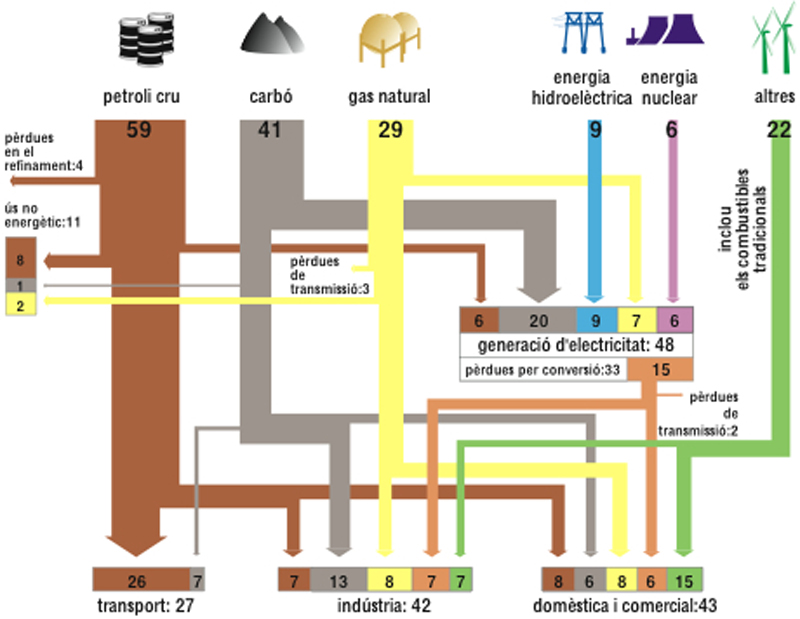
Flux mundial d’energia en milions de barrils de petroli per dia
© Fototeca.cat
Física
Química
Tecnologia energètica
Energia
Capacitat d’un sistema físic per a produir un treball.
Aquesta definició, bé que és la més estesa, pot induir a error a causa de la vaguetat del terme “capacitat”, i, per tant, és millor de definir l’energia com allò que, en produir-se un treball, disminueix en una quantitat igual al treball produït L’energia, doncs, és mesurada en les mateixes unitats que el treball La noció d’energia, latent ja en la mecànica clàssica, apareix definida com a conseqüència de les investigacions de JP Joule i NLS Carnot sobre la interconversió calor, treball mecànic i gràcies a la teoria de HLF Helmholtz que relaciona el treball fet per un sistema isotèrmic amb l’…