Resultats de la cerca
Es mostren 96 resultats
potencial químic
Química
Per a cada constituent d’una mescla, derivada del potencial termodinàmic respecte al nombre de partícules del constituent considerat.
També és anomenat energia lliure molar parcial
potencial termodinàmic
Química
Nom donat a l’energia lliure de Gibbs d’un sistema termodinàmic G = H-TS, essent H l’entalpia, T la temperatura absoluta i S l’entropia del sistema.
potencial d’elèctrode
Potencial d’elèctrode
©
Química
Estat d’equilibri elèctric d’una substància (element químic o compost) que és submergida en una dissolució que la conté en forma iònica.
Formalment, és expressat per la equació o llei de Nernst El potencial d’elèctrode d’una substància no pot ésser mesurat d’una manera absoluta, sinó formant una pila amb una altra que és presa com a referència de potencial zero Hom acostuma a prendre com a referència l' elèctrode d'hidrogen o l' elèctrode de calomelans
energia d’ionització
Física
Química
Energia necessària perquè un electró lligat a un àtom o a una molècula pugui escapar-se del sistema al qual pertany.
Hom la mesura en eV
cronopotenciometria
Química
Tècnica electroanalítica basada en la determinació de la variació, en funció del temps, del potencial d’un elèctrode actiu durant l’electròlisi, a corrent constant, de la solució problema.
Aquest potencial depèn de la natura de la substància que reacciona i, a mesura que en el transcurs de l’electròlisi varia la raó de les concentracions de les formes oxidada i reduïda d’aquesta substància en la capa de solució immediata a l’elèctrode, va variant suaument Com que la substància electroactiva només pot arribar a aquesta capa per difusió per tal com hom hi evita, pels mètodes usuals en electroanàlisi, els mecanismes de transport per migració iònica i per convecció, arriba un moment que la concentració tendeix a zero En aquest moment, el potencial de l’…
biamperometria
Química
Tècnica electroanalítica de detecció del punt final d’una volumetria, relacionada amb l’amperometria i basada en l’ús de dos microelèctrodes inerts polaritzats, entre els quals hom aplica una petita diferència de potencial (potencial de polarització).
Si la solució que hom valora conté els dos membres d’un parell redox reversible —per exemple, iode-iodur, ions ferroII-ferroIII, etc—, aquesta diferència de potencial és suficient per a provocar el pas d’un corrent elèctric detectable en un galvanòmetre muntat entre els microelèctrodes, en un dels quals té lloc la reducció i en l’altre l’oxidació del parell mencionat, corrent que s’anulla, en el moment del punt final, quan desapareix de la solució un dels dos membres del parell Quan el parell redox present en la solució problema és irreversible, no passa corrent durant la…
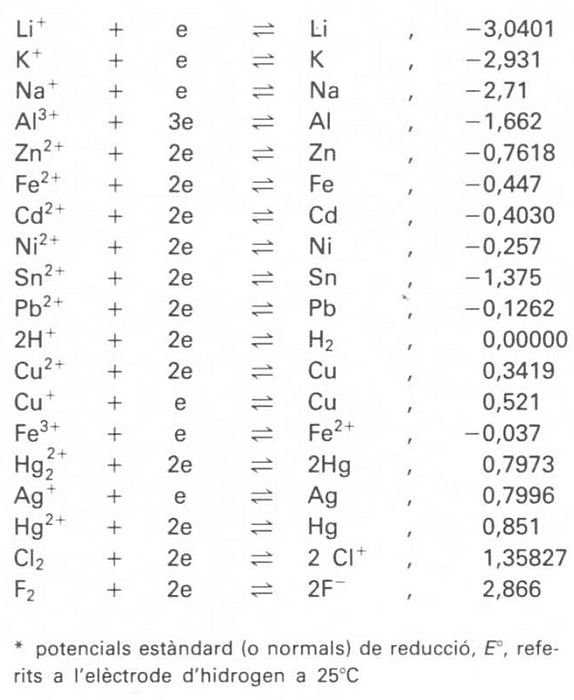
potenciometria
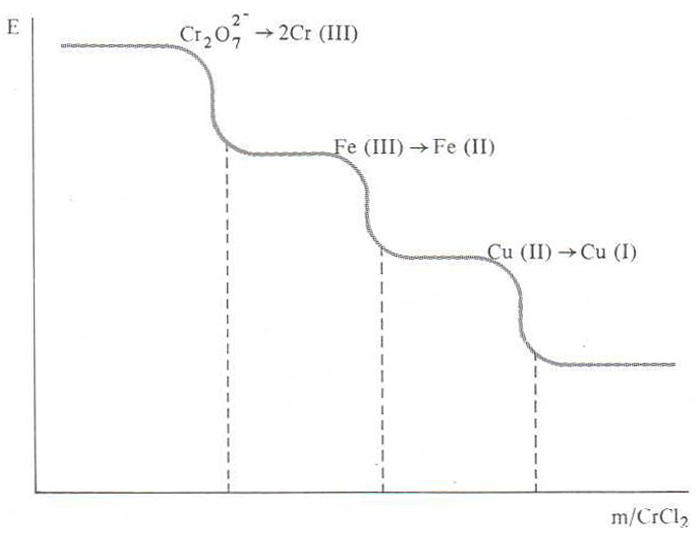
Potenciometria
© Fototeca.cat
Química
Procediment analític utilitzat per a determinar el punt final de les volumetries, basat en la variació del potencial d’un elèctrode en funció de la variació de la concentració dels ions de l’element que el constitueix en la dissolució problema, d’acord amb l’equació (o llei) de Nernst, al llarg de l’addició d’un reactiu valorant.
Aquesta tècnica troba aplicació en volumetries àcid-base, atesa la dependència del potencial d’un elèctrode, com el d’hidrogen, emprat comunament com a referència, amb la concentració dels seus ions en el si de la dissolució a valorar, i el punt final es caracteritza per una sobtada variació del potencial en afegir una petita quantitat del reactiu valorant també troba aplicació en les volumetries de precipitació, amb un fonament anàleg al de les àcid-base, i és de gran valor per a la determinació d’halogenurs i de cianur amb l’ió argent, Ag + Amb tot, l’aplicació…
polarografia
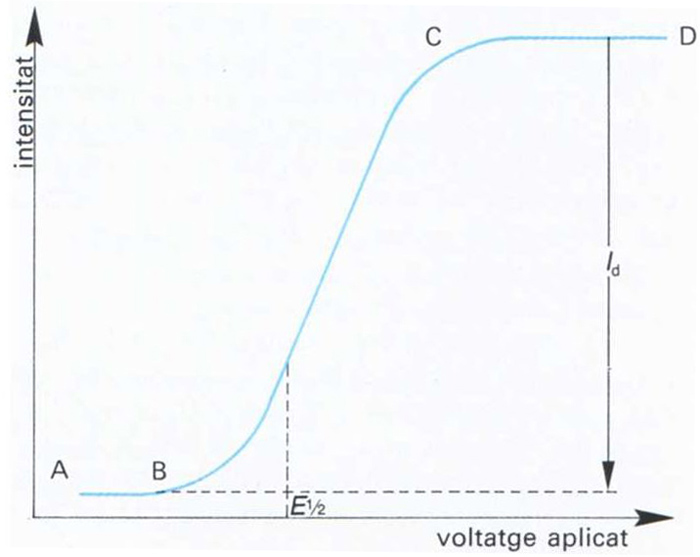
fototeca.cat
©
Química
Branca de l’electroquímica que estudia la variació de la intensitat de corrent en funció del potencial aplicat a un microelèctrode en unes condicions en les quals la velocitat d’electròlisi és determinada per la difusió de l’espècie oxidable o reductible cap a l’esmentat elèctrode.
En les determinacions polarogràfiques hom empra una cella electrolítica consistent en un elèctrode d’àrea petita o microelèctrode El microelèctrode més comunament emprat és el de gotes de mercuri, consistent en un tub capillar molt fi a través del qual flueix lentament mercuri, que es desprèn en forma de gotes petites, les quals cauen sobre una gran superfície del mateix element, que constitueix l’altre elèctrode Quan hom aplica un voltatge variable a la cella, l’elèctrode de gran superfície resta inalterat, mentre que el microelèctrode experimenta un canvi de potencial, és a dir…
teoria de Stern
Química
La més completa de les teories de la doble capa elèctrica, enunciada per O. Stern l’any 1924 i que combina el concepte de doble capa rígida de Helmholtz amb el de la capa difusa de Gouy i Chapman.
La teoria de Stern és basada en la suposició que la distribució d’ions ha d’ésser fortament influïda per les forces existents entre aquests ions i la superfície que hom considera i, atesa la ràpida disminució amb la distància d’aquestes forces, prediu la formació d’una monocapa d’ions fortament adherida a la superfície considerada, així com l’existència d’una capa difusa D’aquesta manera, el potencial total general a la interfase ψ o , pot ésser expressat per ψ o = ψ r + ψ d , essent ψ r la caiguda de potencial de la capa rígida i ψ d la de la capa difusa
semireacció
Química
En una reacció d’oxidoreducció, cadascun dels processos d’oxidació o de reducció quan hom els considera, artificiosament, per separat.
Les semireaccions són representades mitjançant equacions químiques en les quals intervenen electrons com a “reactius” en un dels dos membres, i tenen associat un potencial d’elèctrode característic L’ús de les semireaccions permet, mitjançant llur combinació apropiada, el càlcul del potencial del sistema considerat i l’estimació —fent servir l’equació de Nernst— de la constant d’equilibri del procés pila Així, en la pila Daniell semireacció d’oxidació anòdica Zn 0 →Zn 2 + +2e - , E 0 o x i d = 0,76 V semireacció de reducció catòdica Cu 2 + +2e - →Cu 0 , E 0 r e d = -0,34 V reacció d’…
Paginació
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- …
- Pàgina següent
- Última pàgina