Resultats de la cerca
Es mostren 38 resultats
punt triple
Física
Punt del diagrama de fases dels sistemes d’un sol component que representa l’estat del sistema en què coexisteixen les tres fases.
D’acord amb la regla de les fases fase 3, l’estat representat pel punt triple és invariant, i, per tant, per a cada sistema hi ha una pressió i una temperatura, anomenades triples Per al sistema aigua sòlida-líquida-vapor és P t = 4,6 torr i T t = 0,007°C Quan un sistema presenta polimorfisme a l’estat sòlid, es poden presentar punts triples entre dues fases sòlides i la líquida o entre dues fases sòlides i la fase vapor o, també, entre tres fases sòlides
fase
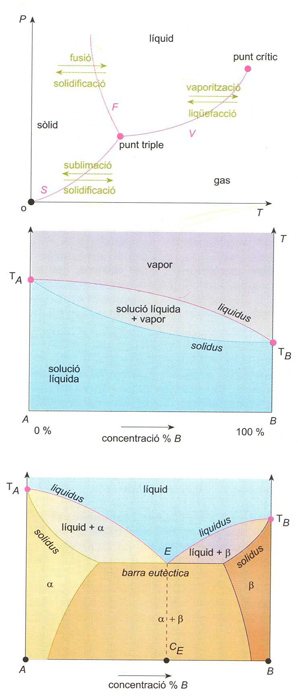
Diagrama de fases: (a) d’un sistema d’un sol component (F, corba de fusió; S, corba de sublimació; V, corba de vaporització); (b) d’un sistema binari líquid-vapor (TA i TB. punts d’ebullició d’A i B); (c) d’un sistema binari solid-líquid eutèctic (TA i TB. punts de fusió d’A i B); E punt eutèctic; CE, composició eutèctica: α i β són les dues fases sòlides que es presenten
© Fototeca.cat
Física
Química
Part d’un sistema, formada per un nombre qualsevol de components, homogènia i amb uns límits ben determinats que la separen de les altres parts del sistema i de la resta de l’univers.
La noció de fase generalitza la d’estat físic sòlid, líquid, gasós i permet distincions més subtils, com la que hi ha entre dues formes de cristallització d’un sòlid Els components d’un sistema són les substàncies que l’integren, i els constituents són les diferents fases que el formen Si només hi ha una fase, el sistema és homogeni , i si n’hi ha més, heterogeni El pas de la fase sòlida a la líquida és anomenat fusió , el de la líquida a la gasosa, vaporització , i el de la sòlida a la gasosa, sublimació Aquests canvis de fase són progressius , i els canvis en sentit contrari…
pressió superficial
Física
En un sistema físic en què hi ha dues fases en contacte, diferència de pressions exercides sobre la superfície que les separa.
Hom l’expressa per P s = 2 α/ r en què a és la tensió superficial de la substància que forma el sistema i r el radi de curvatura de la superfície de separació de les dues fases La diferència de pressió entre l’interior i l’exterior d’una bombolla de sabó és un exemple de pressió superficial
cicle Stirling
Física
Tecnologia
Cicle termodinàmic teòric d’una màquina tèrmica reversible constituït per la successió de les quatre fases per les quals evoluciona un gas perfecte, entre dues fonts de calor a temperatura constant, separades per un bescanviador adiabàtic.
Les quatre fases són les següents una compressió isotèrmica del gas en contacte amb la font freda un reescalfament a volum constant fins a la temperatura de la font calenta una expansió isotèrmica del gas en contacte amb la font calenta, i un refredament en el bescanviador fins a la temperatura de la font freda El rendiment del cicle teòric de Stirling és igual al rendiment màxim de Carnot d’una màquina ideal que evoluciona entre les mateixes fonts calenta i freda El cicle Stirling ha estat adaptat a la realització de prototips de motors de combustió externa, del tipus de motor…
variància
Física
En un sistema termodinàmic, nombre màxim de variables termodinàmiques intensives (pressió, temperatura, etc) independents.
La variància depèn del nombre de components i de fases del sistema, i és calculada mitjançant la regla de les fases fase 3
estat termodinàmic crític
Física
Estat d’una substància pura a una pressió i temperatures tals que les fases gasosa i líquida no poden existir ja com a fases separades.
funció de Gibbs
Física
Funció termodinàmica G definida per l’equació G = U-TS+pV = H-TS (U essent-hi l’energia interna, T la temperatura absoluta, S l’entropia, p la pressió, V el volum i H l’entalpia).
Anomenada també entalpia lliure , és una funció d’estat del sistema considerat Una propietat important és que, per a un sistema en equilibri, la funció de Gibbs específica té el mateix valor per a les fases líquida i gasosa Una conseqüència d’aquesta propietat és la regla de les fases o de Gibbs fase
desfasament
Electrònica i informàtica
Física
Diferència entre les fases instantànies de dues magnituds periòdiques de la mateixa freqüència.
En corrent altern hom parla generalment del desfasament existent entre la tensió i el corrent, el qual desfasament es dóna sempre que la càrrega no és resistiva pura, sinó que presenta una component reactiva Sovint el desfasament és expressat com un angle angle de desfasament , un temps o una fracció de període Segons el signe del desfasament, hom parla d' avanç de fase o de retard de fase
concordança de fase
Física
Estat de dues ones sinusoidals del mateix període en fase.
Així doncs, les fases a l’origen d’ambdues són iguals i, per tant, la diferència de fase o desfasament entre totes dues és nulla
Frederik Zernike

Frits Zernike
© Fototeca.cat
Física
Físic neerlandès.
Fou professor a Groningen Féu investigacions en òptica, i ideà el microscopi de contrast de fases, per la qual cosa el 1953 rebé el premi Nobel de física Fou membre de la Royal Society