Resultats de la cerca
Es mostren 42 resultats
model de la gota líquida
Física
Teoria proposada per N. Bohr i J.A. Wheeler el 1939 per a explicar l’estructura del nucli atòmic, i que suggerí una analogia entre els nucleons d’un nucli i les molècules d’una gota d’un líquid.
Donava una imatge simple de la fissió i de l’espallació
acumulador de calor
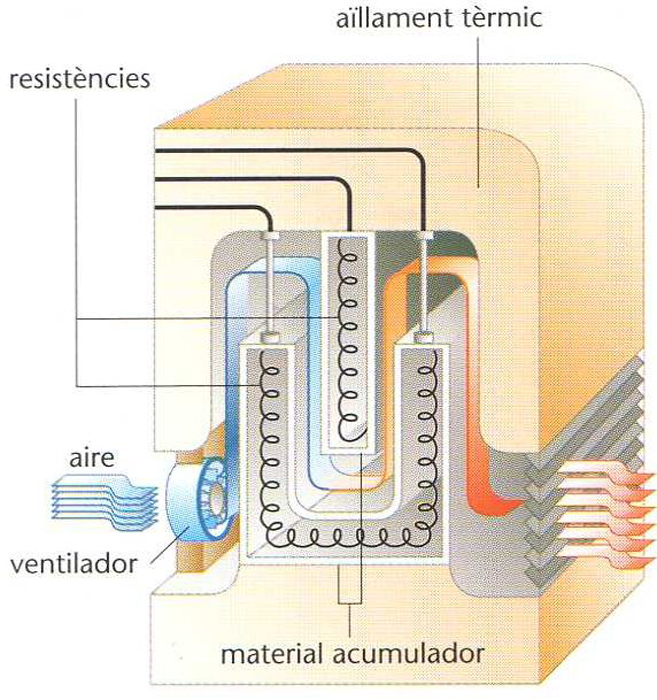
Acumulador de calor
© Fototeca.cat
Física
Massa sòlida o líquida capaç d’ésser escalfada en un moment donat, per cedir posteriorment la calor.
La matèria acumuladora, substància d’una calor específica elevada aigua, oli, salmorra, d’una calor latent elevada sals de baix punt de fusió o materials barats i amb una gran superfície de contacte trossos de ceràmica, maons o pedres, està continguda dins un recipient metàllic o de formigó, de forma cilíndrica o esfèrica, soterrat i aïllat tèrmicament Quan la substància acumuladora és sòlida, cal un fluid de transport —aire o aigua— per tal de carregar o descarregar l’acumulador si és líquida o gasosa, ella mateixa en fa la funció Generalment és utilitzat en sistemes de…
tensió superficial
Física
Manifestació de les forces de cohesió moleculars d’una substància líquida o en dissolució, en la superfície de separació amb un altre medi, que tendeix a conferir-li la forma de mínima energia potencial.
Pot ésser determinada experimentalment mitjançant la mesura del treball necessari per a augmentar la superfície líquida en una unitat d’àrea Per això s’expressa en J/m 2 , si bé, de vegades, hom simplifica l’equació de dimensions reduint-la a N/m
estat líquid

L’aigua, exemple d’estat líquid
(CC0)
Física
Estat de la matèria en què les molècules resten relativament lliures i poden canviar llur posició respectiva, però les forces de cohesió les obliguen a mantenir-se en un volum fix.
Els líquids ocupen un volum pràcticament constant en funció de la temperatura o la pressió L’estat líquid és l’intermedi entre el sòlid i el gasós els líquids i els gasos són anomenats fluids , i ambdós tenen una gran mobilitat molecular, manifestada en la difusió entre líquids o entre gasos, i no presenten rigidesa ni forma particular d’altra banda, líquids i sòlids constitueixen els estats condensats de la matèria, amb poca compressibilitat i amb interaccions moleculars elevades Dins un líquid, les molècules són atretes igualment en totes direccions per les veïnes i, per tant,…
punt triple
Física
Punt del diagrama de fases dels sistemes d’un sol component que representa l’estat del sistema en què coexisteixen les tres fases.
D’acord amb la regla de les fases fase 3, l’estat representat pel punt triple és invariant, i, per tant, per a cada sistema hi ha una pressió i una temperatura, anomenades triples Per al sistema aigua sòlida-líquida-vapor és P t = 4,6 torr i T t = 0,007°C Quan un sistema presenta polimorfisme a l’estat sòlid, es poden presentar punts triples entre dues fases sòlides i la líquida o entre dues fases sòlides i la fase vapor o, també, entre tres fases sòlides
estat d’agregació
Física
Estat d’un sistema material segons el grau de cohesió de les molècules que el formen.
Segons l’estat d’agregació, un sistema material es pot presentar en tres fases fonamentals, sòlida, líquida i gasosa , i hom anomena canvi d’estat o canvi de fase el pas d’un d’ells a un altre qualsevol
funció de Gibbs
Física
Funció termodinàmica G definida per l’equació G = U-TS+pV = H-TS (U essent-hi l’energia interna, T la temperatura absoluta, S l’entropia, p la pressió, V el volum i H l’entalpia).
Anomenada també entalpia lliure , és una funció d’estat del sistema considerat Una propietat important és que, per a un sistema en equilibri, la funció de Gibbs específica té el mateix valor per a les fases líquida i gasosa Una conseqüència d’aquesta propietat és la regla de les fases o de Gibbs fase
tercer principi de la termodinàmica
Física
Principi segons el qual en el zero absolut de temperatura la variació d’entropia d’un sistema en un procés isotèrmic tendeix a zero.
Aquest principi emana del teorema de Nernst, enunciat el 1906 i completat per Planck el 1912 amb la hipòtesi que en el zero absolut l’entropia de qualsevol substància sòlida o líquida pura és zero Una conseqüència del tercer principi és que el zero absolut no es pot atènyer amb un nombre finit de transformacions termodinàmiques
crioscòpia
Física
Química
Estudi dels fenòmens relatius al punt de congelació de dissolucions.
La llei fonamental de la crioscòpia indica que el desplaçament de la temperatura de congelació d’una dissolució T respecte a la del dissolvent pur T dis és Δ T = T-T dis = KC S -C L / M , essent C S la concentració de la dissolució en fase sòlida, C L la concentració en fase líquida, i K la constant crioscòpica del dissolvent
vaporització
Física
Pas de l’estat líquid a l’estat gasós.
Semblantment a la fusió, en augmentar per temperatura l’energia cinètica de les molècules que formen una substància o per descompressió la distància entre elles es produeix el canvi d’agregació de la matèria que fa passar de l’estat líquid al gasós Segons les condicions en què té lloc la vaporització d’un líquid aquesta s’anomena evaporació o ebullició en el primer cas es manifesta en la superfície del líquid a qualsevol temperatura, i en el segon en tota la massa i a temperatura constant tensió de vapor Hom anomena calor de vaporització la calor necessària per a convertir en gas un gram o un…