El secret químic de l'aromaticitat molecular
-
- Home
-
- 1 of 14
Aquest post és una traducció al català de l’article "El secreto de la aromaticidad molecular" publicat a The conversation.
El 2025 serà l’Any Internacional de la Ciència i la Tecnologia Quàntica. Així ho va decidir l’Organització de les Nacions Unides perquè aquest any es compleix un segle del desenvolupament inicial de la mecànica quàntica.
Un dels suports rebuts per a aquesta commemoració ha estat el de la Unió Internacional de Química Pura i Aplicada (IUPAC). El seu vistiplau no és sorprenent, ja que la química és, fonamentalment, l’estudi de la matèria i els canvis que pateix. En aquests canvis és central el paper dels electrons, actors clau en la formació i la ruptura d’enllaços químics que alhora governen les reaccions químiques i les propietats de les substàncies. I el comportament dels electrons només es pot descriure correctament mitjançant la mecànica quàntica. De la mateixa manera, l’aromaticitat és una propietat d’alguns enllaços químics que només es pot entendre amb la mecànica quàntica.
Considerem dos circuits, un obert i un altre tancat (Figura 1), de la mateixa longitud i suposem que el pilot Marc Márquez amb la seva Ducati els recorre d’A a B a la mateixa velocitat constant. Com que tots dos tenen la mateixa longitud, la quantitat de combustible/energia utilitzada per recórrer aquests dos circuits serà la mateixa. Aquest resultat és l’esperat a la mecànica clàssica.
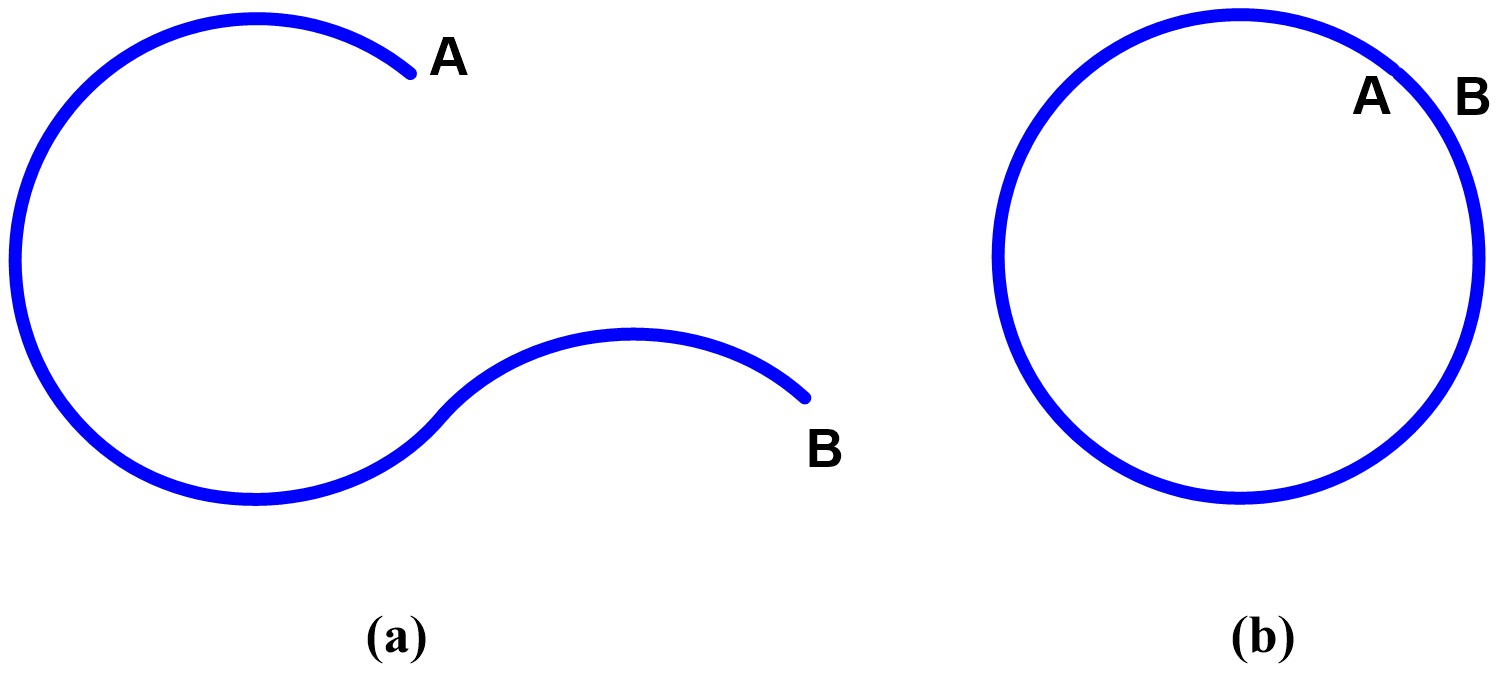
Figura 1. Els dos possibles circuits de la mateixa longitud: (a) circuit obert i (b) circuit tancat.
Si ara tenim un electró als dos circuits, l’electró que es mou al circuit tancat ho fa amb una energia menor que el que es mou al circuit obert. Aquesta diferència només es pot explicar amb la mecànica quàntica.
Les molècules que tenen electrons que es mouen en circuits tancats en dues o tres dimensions tenen una energia menor que les que es mouen en circuits oberts i, per tant, donen lloc a compostos més estables. Aquest és l’origen quàntic de l’aromaticitat.
D’olor dolça
El benzè, la molècula aromàtica per excel·lència, va ser descrit per Michael Faraday el 1825. Uns anys més tard, Eilhard Mitscherlich va descobrir que la seva fórmula química era C₆H₆. Al segle XIX van proliferar troballes similars, amb molts altres compostos que mostraven baixes relacions carboni/hidrogen i olors agradables que semblaven relacionats amb el benzè. En aquesta època, el 1856, August Wilhelm von Hofmann va ser el primer a utilitzar el terme “aromàtic” per referir-se a aquest grup de compostos. L’etimologia de la paraula és incerta, però està relacionada amb l’olor particular que desprenen.
Al benzè, diferenciem els parells d’electrons que formen els enllaços C–H i C–C (que estan localitzats i tenen baixa mobilitat) dels electrons π, que estan deslocalitzats al llarg de tot l’anell i són molt mòbils. L’aromaticitat del benzè prové de l’estabilitat que proporcionen els electrons π en moure’s pel circuit tancat d’aquesta molècula cíclica. La seva estructura molecular és altament simètrica amb tots els enllaços C–C de la mateixa longitud. De vegades, es representa per un hexàgon amb un cercle a l'interior, una indicació de la mobilitat dels electrons π. La presència d’aquests electrons π fa que la molècula sigui més estable i menys reactiva que molècules similars en disposició lineal (en lloc de cíclica).
Molècules més estables
Un aspecte important dels compostos aromàtics és la seva major estabilitat energètica i química (són molècules poc reactives) en comparació amb els anàlegs lineals. A banda del benzè, un altre exemple emblemàtic és la piridina, molècula heteroaromàtica en què un grup CH del benzè ha estat substituït per un àtom de nitrogen (Figura 2). O el coronè, un hidrocarbur aromàtic policíclic format per la fusió de set anells de benzè. També tenim el dianió aromàtic tridimensional closo-hexaborà, el B₆H₆²⁻, amb una geometria molecular octaèdrica. O la primera molècula aromàtica totalment metàl·lica, descoberta el 2001, l’Al₄²⁻, amb una geometria quadrada plana.
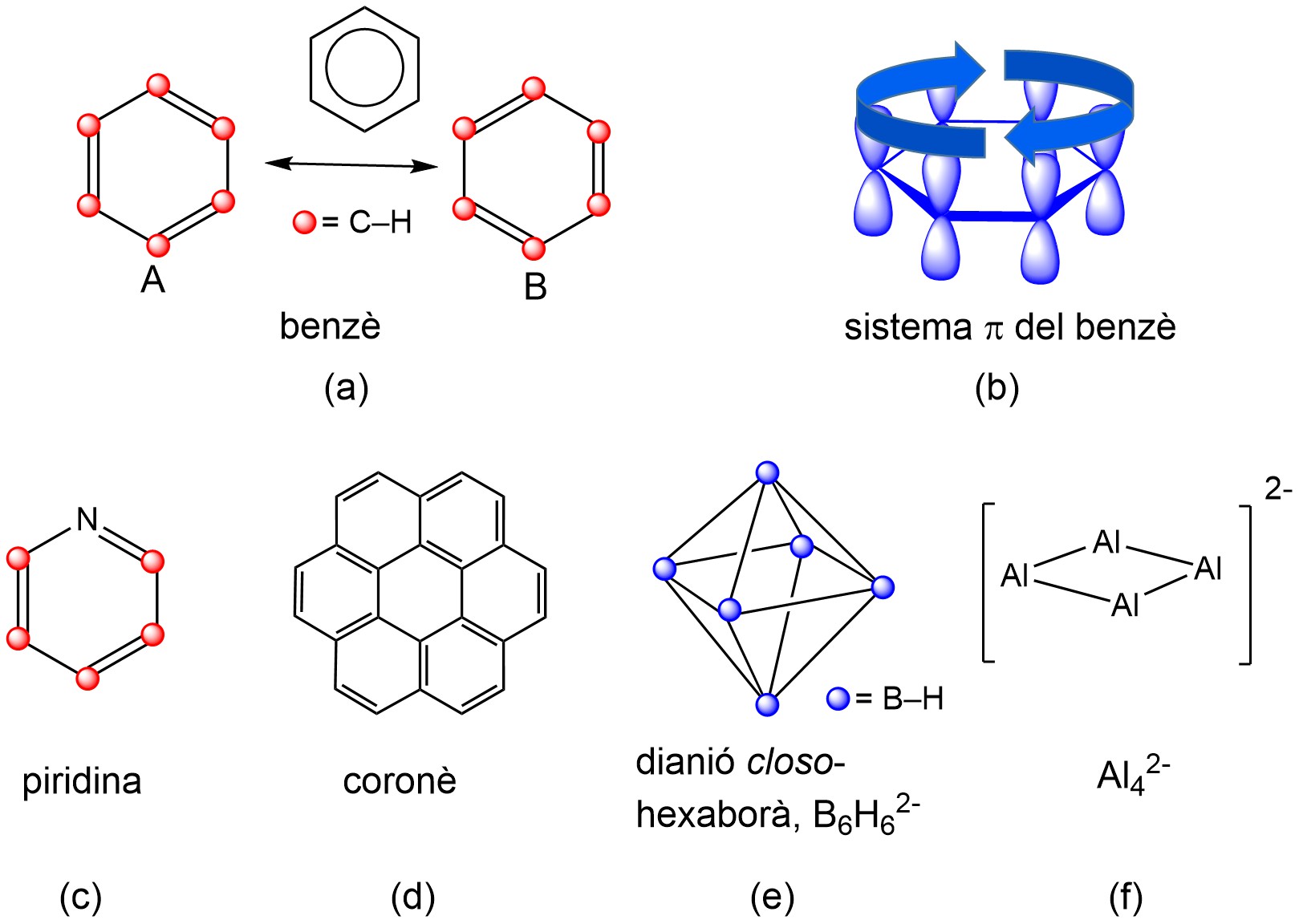
Figura 2. (a) Estructura del benzè; (b) les fletxes indiquen la mobilitat dels electrons π en el benzè tant a dalt com a baix del pla molecular; (c) estructura molecular de la piridina; (d) coronè; (e) closo-hexaborà B₆H₆²⁻ i (f) Al₄²⁻, un compost aromàtic totalment metàl·lic.
De fet, la quantitat d’exemples de molècules aromàtiques és enorme. Es calcula que, entre els aproximadament 120 milions de compostos coneguts fins ara, dos terços són aromàtics o tenen anells aromàtics a la seva estructura.
Les molècules aromàtiques són habituals als laboratoris
L’aromaticitat i la reactivitat són dos conceptes profundament relacionats. Quan Michael Faraday va obtenir el benzè el 1825, ja va observar que era molt menys reactiu que el compost lineal trans-2-butè. Des d’aleshores, aquesta reactivitat reduïda ha estat considerada una característica experimental dels compostos aromàtics.
Per a una reacció donada, l’energia de reacció és la diferència d’energia entre els reactius i els productes. Com més estables siguin els productes, més afavorida serà la reacció. D’altra banda, la barrera energètica és la diferència d’energia entre els reactius i l’estructura menys estable en el camí (anomenat estat de transició) que porta dels reactius als productes. Com més petita sigui la barrera energètica, més ràpida serà la reacció.
Les energies de reacció i les barreres energètiques de moltes reaccions estan influïdes pels canvis en l’aromaticitat. Si els investigadors volen accelerar una reacció, cercaran reactius no aromàtics, estats de transició i productes aromàtics. Perquè, si els estats de transició i els productes són aromàtics, seran més estables i faran que la reacció sigui més eficient.
L’aromaticitat és, per tant, un concepte àmpliament utilitzat per la comunitat química. Com a prova d’això, el terme apareix a més de 40 articles científics publicats cada dia!