Les bateries del futur (pròxim): bateries d'estat sòlid
-
- Home
-
- 3 of 4
El concepte de bateria sempre ha estat present. De fet, semblaria que les bateries han estat presents tota la vida, però tot i que el concepte de bateria és molt més vell que tots nosaltres, no sempre han estat aquí. Des del primer plantejament seriós d’Alessandro Volta als voltants de l’any 18801, amb una barreja de discos metàl·lics amb draps en salmorra, fins al reconeixement, amb el premi Nobel de química del 2019 als inventors i descobridors dels materials i la química que fan possible les bateries d’ió liti2, hi ha un camí de desenvolupament tecnològic que ens deixa a les portes d’un món on les bateries estan cridades a tenir un paper fonamental en la transició energètica.
En comparació amb les seves predecessores, les bateries d’ió liti són més lleugeres i més potents, fet que les ha posat al capdavant de la revolució digital de les dues últimes dècades. L’altre factor que les ha fet dominar el mercat ha estat la impressionant baixada de costos en la seva producció: des de la seva comercialització per Sony el 1991, el preu ha baixat un 97%.3
És precisament aquest decreixement del preu el que, de nou, ha tornat a obrir les portes d’una nova tecnologia viable a gran escala: els vehicles elèctrics. Aquests vehicles, per cert, tenen una llarga història, com s’ha explicat en els articles publicats a Divulcat: Un viatge amb cotxe elèctric cap al món recarregable. En qualsevol cas, si una cosa tenen en comú les bateries per a vehicles elèctrics moderns i les bateries dels nostres dispositius electrònics és que en essència la tecnologia és la mateixa que va ser comercialitzada el 1991. Però, quin és el funcionament d’aquesta tecnologia? Us ho expliquem!
Com funciona una bateria?
Una bateria és un dispositiu electroquímic que transforma l’energia emmagatzemada en una reacció química en energia elèctrica. Si la bateria és recarregable, llavors el procés electroquímic és reversible, és a dir, podem invertir energia a produir la reacció química inversa per carregar-la i tornar a emmagatzemar l’energia elèctrica en la reacció química.
Els components bàsics d’una bateria són quatre: l’ànode, el càtode, l’electròlit i el separador. D’una banda, el càtode i l’ànode són els materials electroquímicament actius. L’elecció dels materials per al càtode i l’ànode determinen el voltatge de la bateria, així com les seves propietats com la capacitat (quantitat de càrrega capaç de subministrar), el nombre de cicles, o la "velocitat" de càrrega i descàrrega.
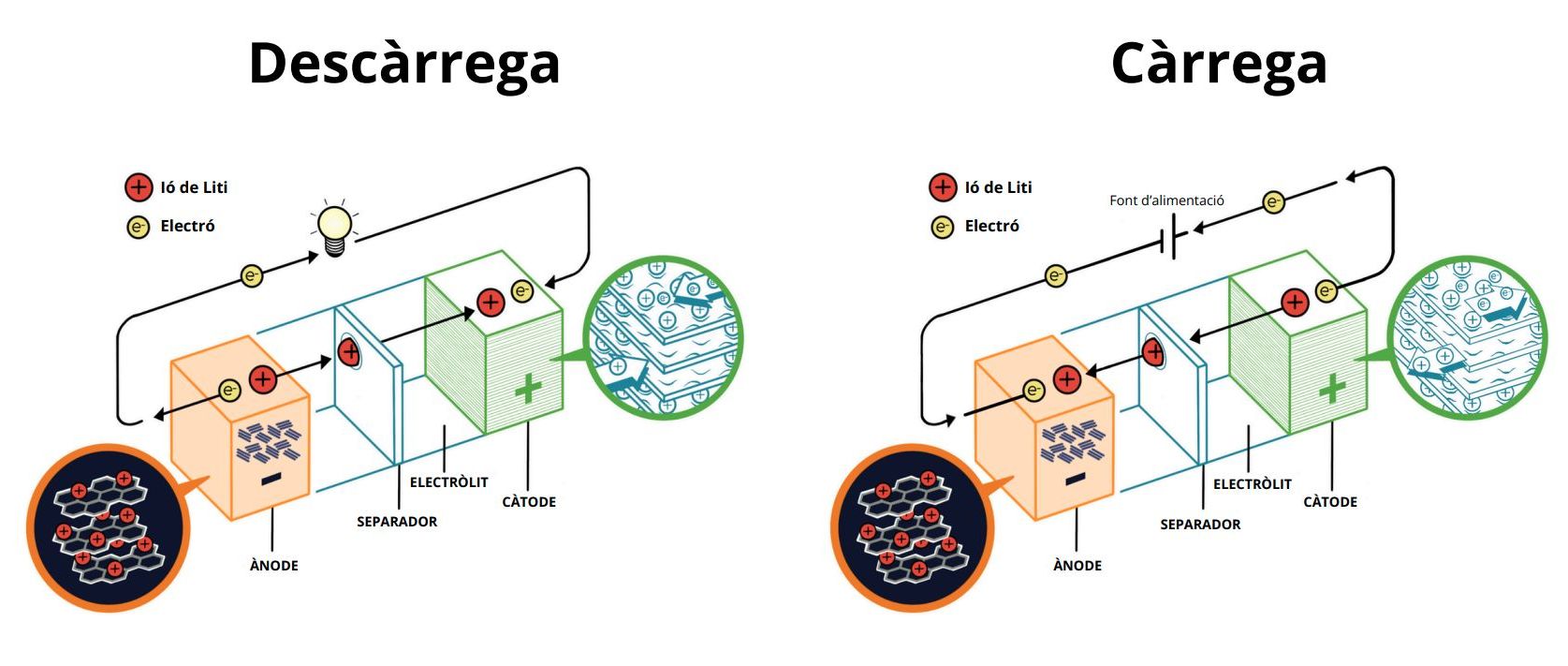
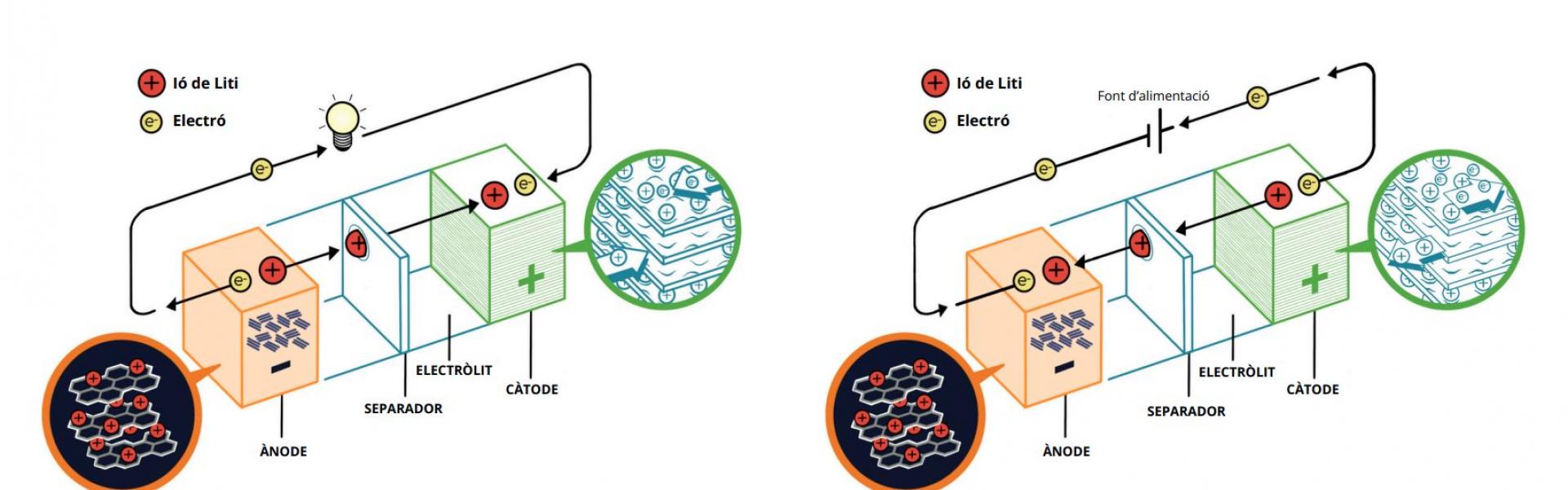
Figura 1. Esquema explicatiu sobre el funcionament d’una bateria d’ió liti durant la seva descàrrega i la seva càrrega - Imatge creada per Princess Romero. © Fundació Institut de Recerca en Energia de Catalunya (IREC)
Quan fem servir una bateria, estem descarregant l’energia que té emmagatzemada. En aquest procés, els ions de liti viatgen de l’ànode al càtode. Simultàniament a aquest moviment d’ions dins de la bateria, els electrons produïts en la reacció química proporcionen el corrent elèctric necessari per alimentar els nostres dispositius electrònics, que fan de circuit extern, tancant el circuit elèctric. I és aquí, en aquest moviment de càrregues, on els altres dos components essencials de les bateries d’ió de liti entren en joc: els anomenats electròlit i separador. Aquests processos estan representats en la Figura 1.
L’electròlit fa la funció d’autopista per als ions de liti, viatjant des de l’ànode al càtode, mentre que prohibeix el pas dels electrons, que, recordem, viatgen per fora de la bateria, és a dir, pel nostre dispositiu electrònic, que funciona gràcies al pas d’aquests electrons per un camí diferenciat. Aquest electròlit és un líquid típicament fet de materials carbonosos, que són inflamables i poden produir reaccions contraproduents si entren en contacte amb l’aigua o l’oxigen, fent malbé la cel·la. L’últim component és el separador, que típicament és un material polimèric porós que permet impregnar-se de l’electròlit líquid permetent, així, el moviment dels ions amunt i avall mentre que evita que el càtode i l’ànode entrin en contacte físic, que acostuma a ser fatal per a la bateria. Cal dir que tant l’ànode com el càtode també estan impregnats d’electròlit.
Quins són els desavantatges dels electròlits actuals?
Malgrat la seva gran capacitat de moure ràpidament els ions de liti de l’ànode al càtode, aquest electròlit té dos desavantatges principals. El primer és que és inflamable i contribueix a l’augment de temperatura accelerat i descontrolat, que pot passar en una bateria en cas d’accident. Aquest és un risc no desitjat en bateries grans, com ara les dels vehicles elèctrics o en equips d’emmagatzematge d’energia, que poden produir incendis que triguen dies a apagar-se.4
El segon desavantatge fa referència a les seves propietats electroquímiques, en particular, a la seva estabilitat a dins d’una finestra de potencial, que així mateix és produïda per la selecció de materials a l’ànode i el càtode. Això vol dir, en termes molt
simplificats, que si volem dissenyar una bateria de més voltatge, hem de tenir cura que l’electròlit triat sigui estable en aquests voltatges.
Quins materials s’utilitzen habitualment a les nostres bateries?
De la banda del càtode, el material històricament més utilitzat és l’òxid de cobalt i liti (LiCoO2), que produeix un voltatge màxim de 4,2 V, mentre que comencen a tenir un destacable protagonisme els fosfats de ferro i liti, que produeixen un voltatge màxim de 3,6 V, aproximadament. Aquests dos materials són estables amb els electròlits orgànics comercials. Però, per exemple, la substitució del ferro per níquel produeix bateries de gairebé 5 V, sobrepassant l’estabilitat de l’electròlit.
De la banda de l’ànode, el material utilitzat àmpliament avui dia (i des de fa dècades) és el grafit, que té una capacitat relativament baixa i que acostuma a ser el factor limitant per poder, per exemple, carregar les bateries més ràpidament. L’ànode ideal seria el liti metàl·lic, que té 10 vegades més capacitat que el grafit. I la raó principal per a no usar fins ara el liti metàl·lic com a ànode és, de nou, la manca d’estabilitat de l’electròlit, que acaba creant dipòsits de liti metàl·lic al llarg de la cel·la, provocant un curtcircuit.
Resumint: si volem construir bateries més segures i que siguin compatibles amb materials que permetin augmentar la capacitat i la potència de la bateria, hem de canviar l’electròlit. Entre les alternatives millor posicionades per afrontar aquests reptes són les anomenades bateries d’estat sòlid.
Bateries d’estat sòlid
En les bateries d’estat sòlid, l’electròlit orgànic i el separador porós són substituïts per un sol element que és sòlid (valgui la redundància) i compleix la doble funció de conduir els ions de liti entre càtode i ànode, i d’evitar el contacte físic entre aquests, tal com es veu en la Figura 2.
Entre els electròlits sòlids que s’han desenvolupat en les últimes dècades5, trobem alguns amb propietats electroquímiques excepcionals: compatibilitat amb liti metàl·lic i càtodes d’alt voltatge, i capacitat de conduir ions de liti gairebé tan bé com als electròlits líquids. S’estima que les bateries d’estat sòlid amb liti metàl·lic poden arribar a augmentar fins a un 35% la densitat energètica gravimètrica (en pes) i un 50% la densitat energètica volumètrica. Aquestes variables són els paràmetres definitius que determinen el rendiment de la bateria, ja que en determinen el pes total i el volum. Llavors, per al cas de les bateries d’estat sòlid, amb el mateix volum que ara fem servir per a la bateria d’un vehicle elèctric, doblaríem la seva capacitat i, per tant, el seu rang de conducció, arribant llavors fàcilment a vehicles capaços de recórrer 1.000 km amb una sola càrrega.
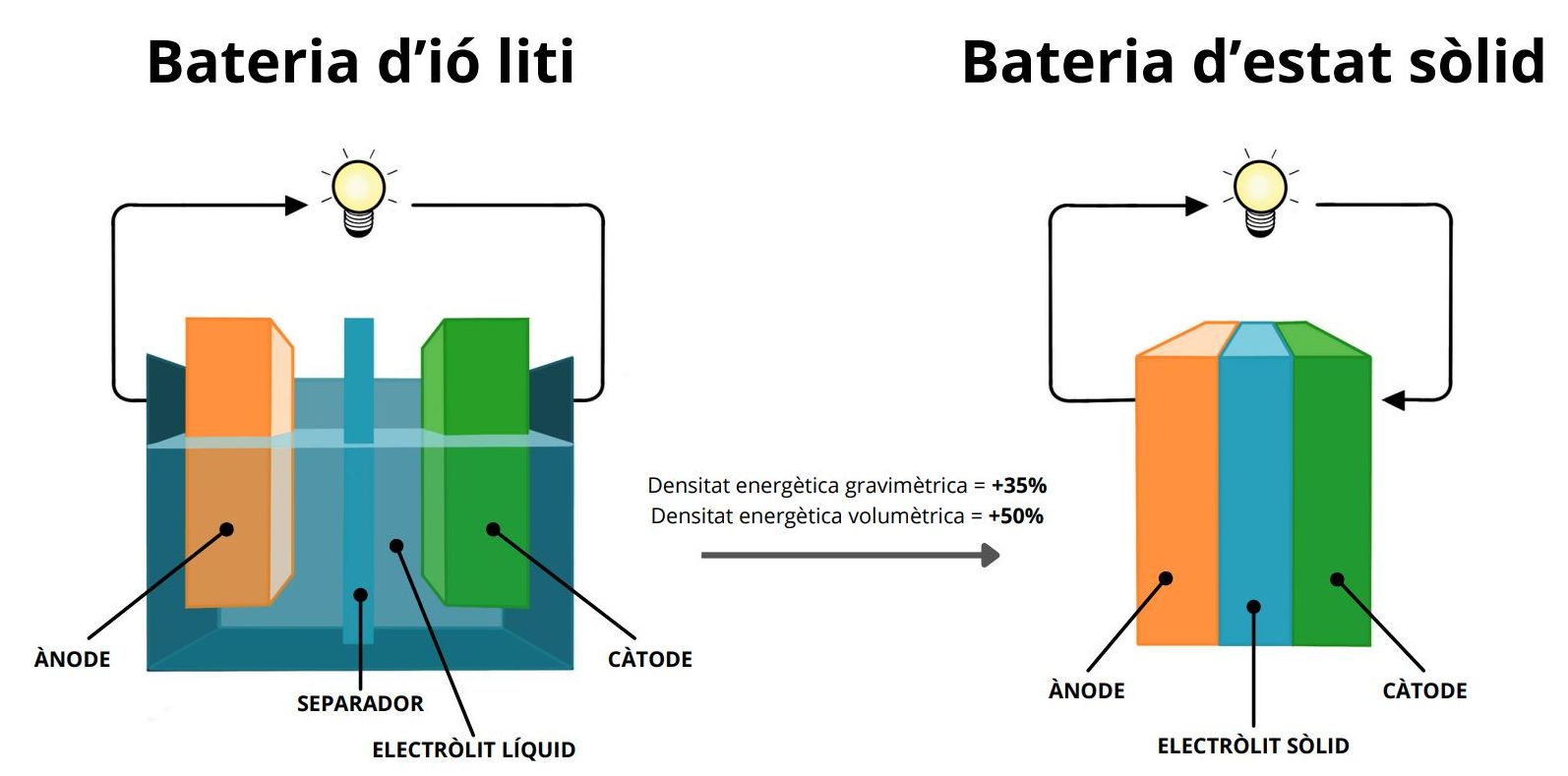
Figura 2. Diferències i similituds entre les bateries d’ió liti i les noves bateries d’estat sòlid - Imatge creada per Princess Romero.© Fundació Institut de Recerca en Energia de Catalunya (IREC)
Aquesta tecnologia basada en electròlits d’estat sòlid està cridada a ser la gran revolució en el món de les bateries en els propers 10 anys. Així, els principals productors de vehicles al món tenen en els seus plans presentar prototips de vehicles amb aquesta tecnologia en el proper lustre. Si bé la tecnologia encara no està del tot enllestida per ser produïda a gran escala, la recerca i la indústria caminen juntes per fer realitat aquest tipus de bateries, que són més segures, potents i duradores.
Referències
1. The Nobel Prize in Chemistry 2019 - Press release (sense data)
2. Alessandro Volta - Electric Battery (sense data)
3. Battery price decline - Our World in Data (sense data)
4. What causes lithium-ion battery fires? Why are they so intense? And how should they be fought? An expert explains (sense data)
5. M. Balaish, J. C. Gonzalez-Rosillo, K. J. Kim, Y. Zhu, Z. D. Hood, and J. L. M. M. Rupp, “Processing thin but robust electrolytes for solid-state batteries,” Nat. Energy, vol. 6, no. 3, pp. 227–239, Mar. 2021, doi: 10.1038/s41560-020-00759-5