Resultats de la cerca
Es mostren 45 resultats
electrofocalització
Química
Tècnica d’electroforesi separativa en capa prima de proteïnes que utilitza com a suport una dissolució d’amfolines (àcids aminocarboxílics sintètics, de punts isoelèctrics diferents i de baix pes molecular) que creen un gradient estable de pH, en ésser sotmeses a una diferència de potencial.
Les proteïnes migren en aquest gradient fins a un pH que correspon a llur punt isoelèctric pI Una diferència de pI de només 0,05 unitats és suficient per a separar-les La capacitat separativa d’aquesta tècnica és molt més alta que l’electroforesi convencional
blau de Prússia
Química
Nom genèric dels composts de color blau resultants de la reacció del ferrocianur de potassi amb l’ió Fe(III), que difereixen en llur estructura, propietats i grau d’hidratació segons el procediment de preparació.
Hom sol representar-los per la fórmula Fe 4 FeCN 6 3 , bé que llur estructura correspon pròpiament a la d’un supercomplex Són insolubles en aigua i àcids excepte en àcid oxàlic, fet que s’aprofita en la fabricació de tintes Són emprats a bastament com a pigments i en el paper heliogràfic
hibridació
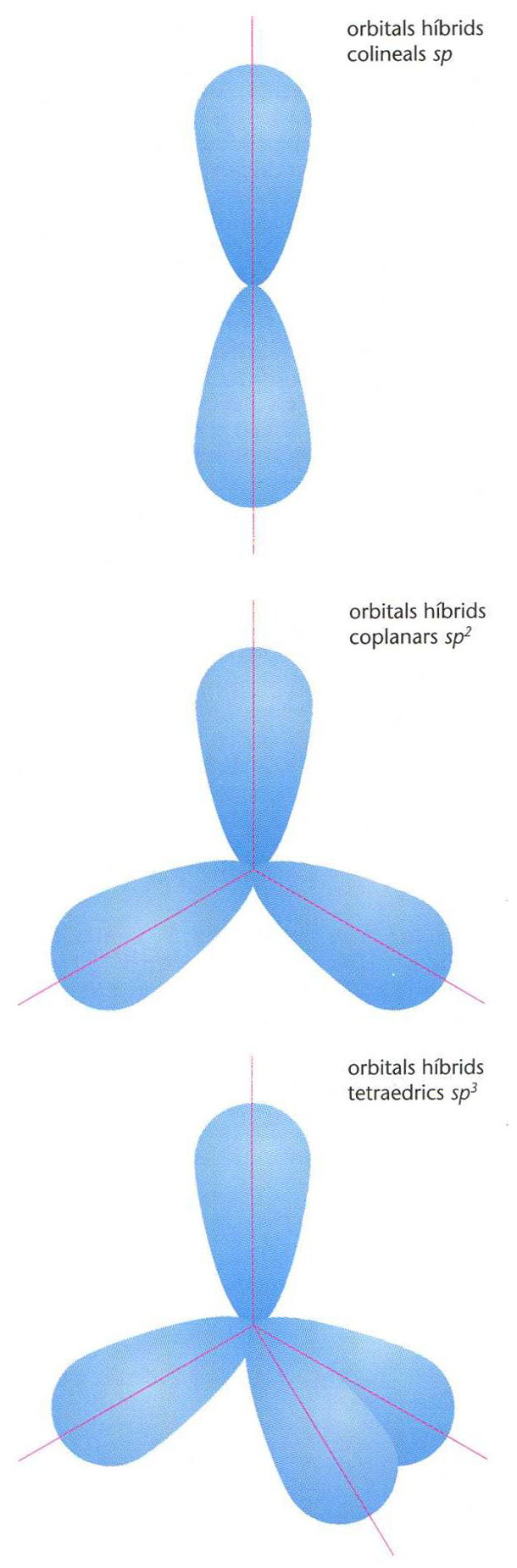
Representació esquemàtica de diferents tipus d’hibridació
© Fototeca.cat
Química
Fenomen que s’esdevé quan dos o més orbitals de nivells energètics pròxims i que tenen els mateixos elements de simetria es combinen per donar el mateix nombre d’orbitals híbrids, equivalents i de nivells energètics més baixos.
Els orbitals poden hibridar-se en diverses proporcions segons l’enllaç format, per a arribar a una configuració de menor energia, i la geometria d’una molècula és determinada per la hibridació dels enllaços que la formen Quan un àtom de carboni només té un dels seus orbitals p hibridat amb l’orbital s , hom diu que presenta hibridació sp té aleshores dos orbitals sp equivalents alineats i dos orbitals p en plans perpendiculars aquests àtoms de carboni sp es troben en derivats acetilènics, nitrils, allens, etc, és a dir, en composts amb triple enllaç, i amb dobles enllaços acumulats Quan un…
pH
Química
Concepte introduït el 1909 per S.P.L.Sorensen per donar una mesura quantitativa de l’acidesa o basicitat d’una dissolució.
Sorensen definí el pH d’una dissolució com el logaritme decimal canviat de signe de la concentració d’ions hidrogen pH = -log H + , i posà a punt un mètode electromètric per a determinar-lo Tot i que aquest mètode ha restat com a definitiu, el concepte primitiu de pH ha sofert diverses transformacions Actualment, el pH és definit d’una manera operativa, segons l’equació pH x - pH r = E x -E r / k , en la qual pH x és el pH de la dissolució desconeguda, pH r el de la dissolució de referència, E x la força electromotriu de la cella H 2 1 atm/dissolució x || elèctrode de referència, E r la…
anàlisi tèrmica
Química
Mètode d’estudi de les mescles, especialment binàries i, en particular, dels aliatges, que té per objecte establir el diagrama d’equilibri, i que consisteix en la determinació de la velocitat de refredament de mescles líquides de composició coneguda.
El disposititu experimental ha d’assegurar un refredament regular i ha de permetre enregistrar la corba de variació de temperatura de la mescla en funció del temps Si és refredat un sòlid que no sofreix transformació polimòrfica, la corba obtinguda és contínua i tendeix asimptòticament vers la temperatura ordinària Qualsevol discontinuïtat amb disminució de pendent, correspon a una disminució de la variància del sistema, és a dir a un augment en el nombre de fases En el cas d’un aliatge binari líquid la primera discontinuïtat indica el començament de cristallització El pendent de…
subòxid de carboni
Química
Diòxid de tricarboni, de fórmula empírica C3O2 (la qual correspon a l’estructural O=C=C=C=O).
Hom l’obté per deshidratació del malonat d’etil o de l’àcid malònic amb un excés d’anhídrid fosfòric a 300°C CH 2 COOC 2 H 5 →C 3 O 2 + 2C 2 H 4 + 2H 2 O En condicions ambient és un gas incolor el punt de fusió és —111°C el punt d’ebullició, + 6°C és poc estable i es descompon a 200°C segons la reacció C 3 O 2 →CO 2 + 2C g r a f a la temperatura ordinària es polimeritza i dóna un sòlid vermell, soluble en l’aigua, de composició no definida
carbonil
Química
Radical bivalent positiu C = O, que pot ésser considerat com a derivat de l’àcid carbònic per pèrdua de dos grups OH.
El clorur de carbonil, COCl 2 , és el fosgen , i l’amida, CONH 2 2 , és la urea Els halurs de carbonil són obtinguts per síntesi entre el monòxid de carboni i els halògens lliures sofreixen fàcilment hidròlisi i amonòlisi i donen halur d’hidrogen i, respectivament, diòxid de carboni o urea En tots els composts de carbonil, COX 2 , la distància C—O és més llarga que la del doble enllaç C=O, i la distància C—X, més curta del que correspon a un enllaç simple cal considerar, doncs, aquests composts com a híbrids de ressonància, segons
diagrama de Frost
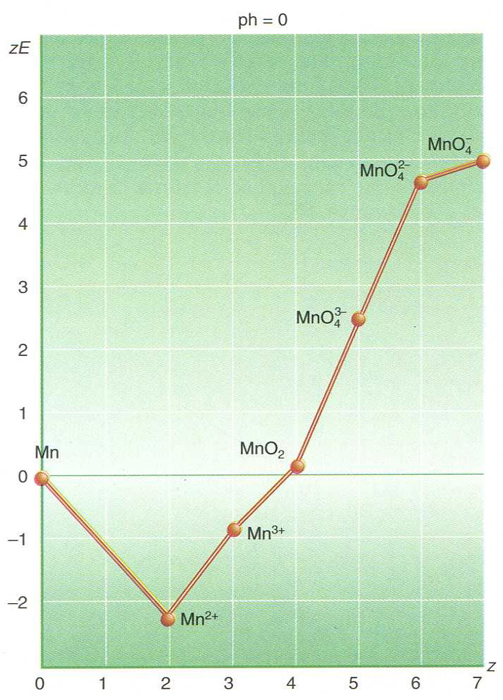
Diagrama de Frost
© Fototeca.cat
Química
Diagrama que indica les reaccions d’oxidoreducció d’un element mitjançant la representació de les espècies químiques que forma en guanyar o perdre electrons o en combinar-se amb hidrogen o oxigen.
A cada espècie correspon un punt d’abscissa z nombre d’oxidació que hi té l’element i d’ordenada -Δ G°/F = zE Δ G° essent l’entalpia lliure de formació estàndard de l’espècie en medi aquós, E el potencial normal de reducció del parell que forma amb l’element, i F el faraday Els diagrames, que poden variar amb el pH, permeten de deduir els potencials redox normals entre les espècies representades i mostren les que són inestables a la desproporcionació Combinats amb els altres elements, aclareixen totalment les reaccions d’oxidoreducció en solució aquosa de l’element considerat, en…
amidina
Química
Nom genèric de les substàncies orgàniques caracteritzades per la presència del grup funcional —C(=NH)NH 2
.
Les amidines R—C=NHNH 2 es designen reemplaçant en el nom de l’àcid RCOOH el sufix -oic o -ic per la terminació -amidina , o la terminació -carboxílic per la terminació -carboxamidina Exemple hexanamidina C 5 H 1 1 C =NHNH 2 Les amidines són obtingudes per l’acció de l’amidur sòdic sobre els nitrils o per acció de l’amoníac sobre els clorhidrats d’iminoèters Tenen caràcter bàsic, donen clorhidrats ben cristallitzats i s’hidrolitzen fàcilment donant amides algunes tenen propietats farmacològiques interessants Les amidines N-substituïdes manifesten el fenomen de la prototropia Així, per…