Resultats de la cerca
Es mostren 93 resultats
equilibri químic
Química
Estat d’un sistema químic (d’una reacció química) en el qual la velocitat de la formació dels productes a partir dels elements reactants és igual a la velocitat de desaparició d’aquells productes per a formar novament els elements inicials de la reacció.
Així, malgrat l’aparent estabilitat del sistema deguda a la invariabilitat de la concentració dels productes presents en la reacció, l’equilibri químic és un equilibri dinàmic, puix que el pas dels reactants a productes resultants, i viceversa, és constant Hom relaciona les activitats activitat i les concentracions dels productes de la reacció amb les dels reactants per mitjà de la llei d’acció de massa acció, que defineix la constant d’equilibri del sistema per a unes determinades condicions de pressió i de temperatura, amb la qual hom determina la…
fase
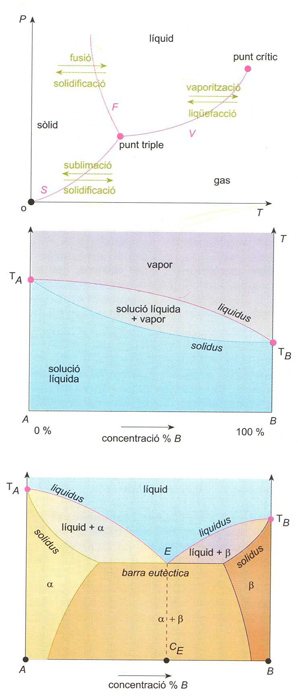
Diagrama de fases: (a) d’un sistema d’un sol component (F, corba de fusió; S, corba de sublimació; V, corba de vaporització); (b) d’un sistema binari líquid-vapor (TA i TB. punts d’ebullició d’A i B); (c) d’un sistema binari solid-líquid eutèctic (TA i TB. punts de fusió d’A i B); E punt eutèctic; CE, composició eutèctica: α i β són les dues fases sòlides que es presenten
© Fototeca.cat
Física
Química
Part d’un sistema, formada per un nombre qualsevol de components, homogènia i amb uns límits ben determinats que la separen de les altres parts del sistema i de la resta de l’univers.
La noció de fase generalitza la d’estat físic sòlid, líquid, gasós i permet distincions més subtils, com la que hi ha entre dues formes de cristallització d’un sòlid Els components d’un sistema són les substàncies que l’integren, i els constituents són les diferents fases que el formen Si només hi ha una fase, el sistema és homogeni , i si n’hi ha més, heterogeni El pas de la fase sòlida a la líquida és anomenat fusió , el de la líquida a la gasosa, vaporització , i el de la sòlida a la gasosa, sublimació Aquests canvis de fase són progressius , i els canvis en sentit contrari són anomenats…
dissociació iònica
Química
Reacció d’equilibri entre una substància en solució i els seus ions.
Segons Svante Arrhenius 1887, les propietats especials de les solucions de tots els electròlits són explicades acceptant que s’hi dóna una fracció de l’electròlit dissociada en ions en equilibri amb la forma molecular no dissociada, equilibri que compleix les lleis generals de les reaccions reversibles Així, hom pot definir una constant de dissociació, determinada a partir del grau de dissociació fracció dissociada, el qual depèn de la concentració i que hom pot avaluar experimentalment a partir de mesures de la conductivitat elèctrica o dels valors de les propietats…
estàtica química
Química
Part de la química que estudia els estats d’equilibri al qual tendeixen els sistemes que experimenten una reacció reversible.
Hom anomena reversibles les reaccions que poden progressar en un sentit o en el sentit invers, i arriben en ambdós casos a un mateix estat d'equilibri químic, que és caracteritzat pels valors de les concentracions dels productes de la reacció i de les substàncies reaccionants que encara hi resten presents, i és modificat conformement a les lleis de JW Gibbs i HL Le Chatelier quan hom altera diverses variables, com les concentracions inicials, les pressions parcials o totals i la temperatura L’estudi quantitatiu de l’estàtica química es desenvolupà a partir de la llei d’acció de…
principi de Le Chatelier
Química
Principi segons el qual, en un sistema químic en equilibri sotmès a circumstàncies exògenes pertorbadores (com variació de la pressió, de la temperatura, etc), l’equilibri tendeix a desplaçar-se en el sentit de contrarestar l’acció produïda.
Aquest principi, anomenat també llei del desplaçament de l’equilibri , fou enunciat independentment per Le Chatelier i F Braun, i és d’una gran importància en el camp de la fisicoquímica i en l’estudi dels desequilibris de fases i de les reaccions químiques
autoprotòlisi
Química
Procés pel qual un solvent amfipròtic es troba en equilibri amb els propis ions, com és el cas de l’aigua, l’amoníac, l’àcid acètic, etc.
D’una manera general, per a un solvent amfipròtic HS la reació d’equilibri és bé que l’equilibri és molt poc desplaçat cap a la formació dels ions
solució sobresaturada
Química
Solució que, a una temperatura determinada, conté una quantitat de solut superior a la que pot estar en equilibri amb el solut no dissolt (solubilitat, producte de solubilitat).
Les solucions sobresaturades es troben en equilibri inestable, però hi ha diverses tècniques per a provocar la precipitació o cristallització parcial fins a assolir un estat d’equilibri Atesa l’existència de factors dissolvent, pH, etc que permeten el manteniment de solucions sobresaturades o que provoquen, convenientment manipulades, llur precipitació, l’estudi de les dissolucions sobresaturades troba una gran aplicació en anàlisi química, tant gravimètrica com volumètrica coprecipitació, oclusió, precipitació, i en processos de cristallització, puix que la…
prototropisme
Química
Tipus de tautomeria
en el qual les dues formes en equilibri són intercanviables mitjançant el desplaçament d’un àtom d’hidrogen.
Aquest concepte fou introduït per TMLowry el 1923 i constituí el primer intent de sistematitzar els fenòmens de tautomerisme Tot i que en un principi s’aplicà als casos en els quals l’espècie migradora era un protó, actualment el concepte ha estat estès a qualsevol tipus de desplaçament d’un àtom d’hidrogen, ja sia per mecanismes iònics, radicalaris o concertats, que condueixin a un equilibri tautomèric Un exemple característic de prototropisme és el tautomerisme cetoenòlic, en el qual simultàniament ocorre una desmotropia
llei d’acció de massa
Química
Llei que estableix la influènica que sobre la composició d’una mescla en equilibri químic exerceixen les concentracions o masses actives de les substàncies que participen en la reacció.
Si la reacció bé representada per l’equació i les substàncies reaccionants B 1 ,,B i ,B' 1 ,,B' i tenen a l’equilibri les activitats a 1 ,,a i ,a' 1 ,,a' i , la llei d’acció s’expressa matemàticament per la relació on K, anomenada constant d’equilibri , és invariable a temperatura constant Quan es tracta de gasos a pressions moderades, que poden ésser assimilats a gasos perfectes , o de solucions diluïdes que obeeixen les lleis dels gasos perfectes, les activitats poden ésser substituïdes, amb aproximació suficient, per les fraccions molars , i aquestes a llur torn…
tautomeria
Química
Tipus d’ isomeria
, conegut també com a isomeria dinàmica
, en la qual les espècies isomèriques existeixen en equilibri i poden interconvertir-se mitjançant processos reversibles.
Històricament, el concepte de tautomeria fou introduït per CLaar l’any 1885 per a explicar el comportament de l’acetoacetat d’etil La diferència entre isomeria i tautomeria és més quantitativa que no pas qualitativa, i depèn fonamentalment de la barrera energètica existent entre les distintes formes tautomèriques d’un sistema determinat Així, formes d’un compost que a una temperatura determinada són fàcilment interconvertibles poden esdevenir estables i àdhuc separables a temperatures prou baixes D’altra banda, la composició d’equilibri d’un sistema tautomèric és determinada, a…
Paginació
- 1
- 2
- 3
- 4
- 5
- 6
- 7
- 8
- 9
- …
- Pàgina següent
- Última pàgina