Resultats de la cerca
Es mostren 28 resultats
valoració
Química
Tècnica d’anàlisi química quantitativa per la qual hom determina la concentració d’una substància que es troba en solució mitjançant l’acció d’un agent valorant, que reacciona amb aquella, ràpidament i quantitativament, fins a arribar al punt final, que és indicat usualment pel viratge d’un indicador (volumetria).
anàlisi conductomètrica
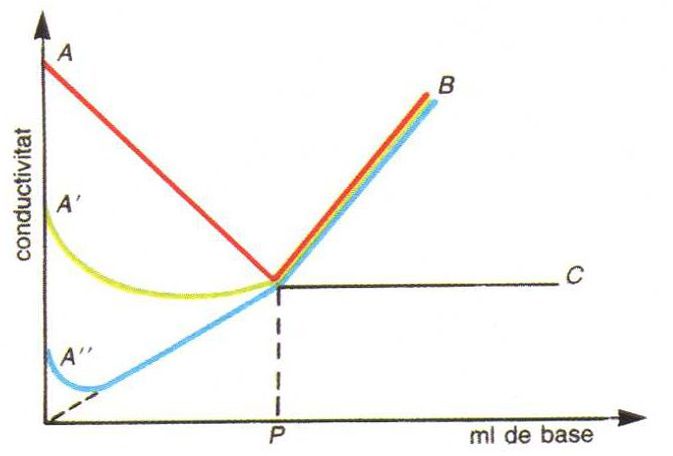
Valoració conductomètrica d’un àcid amb una base: corba AB, àcid fort amb una base forta; corba A'B, àcid mitjanament fort amb una base forta; corba A''B àcid feble amb una base feble; P, punt d’equivalència
©
Química
Procediment analític usat per a determinar el punt final de les volumetries, basat en la mesura de la variació de la conductivitat electrolítica de la solució problema deguda a l’addició de reactiu valorant.
Com que la conductivitat electrolítica depèn de la mobilitat dels ions presents en la solució i de llurs concentracions, l’addició d’un reactiu en provoca canvis importants sempre que doni lloc a la desaparició d’una espècie iònica de la solució sigui per formació d’un compost poc dissociat o d’una sal insoluble i a la seva substitució per quantitats equivalents d’un dels ions del reactiu de mobilitat diferent de la de l’espècie eliminada Així, hom pot dur a terme conductimètricament volumetries de neutralització, de precipitació i de formació de complexos, però només en casos favorables…
acidimetria
Química
Part de la volumetria
que comprèn els mètodes d’anàlisi de substàncies de caràcter bàsic per valoració amb una solució d’un àcid de concentració coneguda.
Els mètodes de l’acidimetria són fonamentats en reaccions de neutralització , quan és una base lliure la que hom valora amb la solució àcida, o de desplaçament , quan la substància valorada és una sal d’un àcid molt dèbil i l’agent valorant un àcid fort Hom calcula la quantitat de substància bàsica problema a partir del volum d’agent valorant àcid necessari perquè la reacció arribi a ésser completa, moment que la solució assoleix un valor específic del pH Hom posa de manifest aquest moment mitjançant l’ús d’alguns dels indicadors de neutralització , substàncies orgàniques àcides o bàsiques…
alcalimetria
Química
Part de la volumetria
que inclou els mètodes d’anàlisi de substàncies àcides per valoració amb una solució d’una base de concentració coneguda.
En general, les solucions bàsiques emprades són bases fortes, en particular els hidròxids de sodi, de potassi o de bari, totes les quals han d’ésser protegides del contacte amb l’atmosfera, ja que absorbeixen el diòxid de carboni, la qual cosa fa que minvi amb el temps llur concentració en base lliure És aconsellable, en conseqüència, de procedir sovint a la determinació d’aquesta per valoració amb un tipus primari de caràcter àcid, com el ftalat àcid de potassi, l’àcid benzoic, l’àcid sulfàmic o el iodat àcid de potassi Com en el cas de l'acidimetria, els mètodes alcalimètrics…
complexometria
Química
Procediment volumètric d’anàlisi quantitativa d’ions metàl·lics per valoració amb una solució patró d’una complexona
, especialment de la sal disòdica de l’àcid etilendiaminotetraacètic (EDTA), basat en la formació de complexos estables dels ions metàl·lics amb l’agent valorant, la qual formació dóna lloc en el punt d’equivalència a una variació brusca de la concentració d’aquells ions, que pot servir de base per a la detecció del punt esmentat.
El comportament de l’EDTA i de les complexones, en general és àmpliament selectiu per tal de poder determinar específicament cada metall cal procedir a la regulació del pH de la solució i a la introducció d’agents complexants auxiliars Així, els ions metàllics tetravalents i trivalents, que formen els complexos més estables, són valorats en medi fortament àcid, mentre que els divalents ho han d’ésser en medi neutre o bàsic segons l’estabilitat de llurs complexos Els agents complexants auxiliars cianur, trietanolamina, 2,3-dimercaptopropanol, etc són emprats per a formar amb els ions…
biamperometria
Química
Tècnica electroanalítica de detecció del punt final d’una volumetria, relacionada amb l’amperometria i basada en l’ús de dos microelèctrodes inerts polaritzats, entre els quals hom aplica una petita diferència de potencial (potencial de polarització).
Si la solució que hom valora conté els dos membres d’un parell redox reversible —per exemple, iode-iodur, ions ferroII-ferroIII, etc—, aquesta diferència de potencial és suficient per a provocar el pas d’un corrent elèctric detectable en un galvanòmetre muntat entre els microelèctrodes, en un dels quals té lloc la reducció i en l’altre l’oxidació del parell mencionat, corrent que s’anulla, en el moment del punt final, quan desapareix de la solució un dels dos membres del parell Quan el parell redox present en la solució problema és irreversible, no passa corrent durant la valoració…
ozonometria
Química
Determinació de l’ozó present en l’atmosfera o en una mescla gasosa.
Habitualment és duta a terme mitjançant l’oxidació de solucions de iodur potàssic i posterior valoració del iode alliberat