Resultats de la cerca
Es mostren 23 resultats
indicadors de Fajans
Química
Cadascun dels indicadors del grup introduït en anàlisi volumètrica per K. Fajans el 1923 per a la detecció del punt final de les volumetries de precipitació, caracteritzats pel fet de tenir diferent color quan es troben lliures en solució i quan es troben adsorbits sobre la superfície del precipitat format en la volumetria, també anomenats indicadors d’adsorció.
Aquests indicadors són àcids febles com la fluoresceïna, la diclorofluoresceïna o l’eosina o bases febles com la rodamina 6 G i l’etoxicrisoïdina, i poden ésser emprats només en un camp de pH limitat segons la valor de llur constant d’ionització
indicador
Química
Compost químic emprat en anàlisi per a posar de manifest, generalment per un canvi de color, el punt d’equivalència de les volumetries.
Els indicadors de neutralització són àcids o bases febles, la forma ionitzada dels quals és de diferent color que la forma molecular El color resultant és així determinat pel valor del pH de la solució que hom valora Els més importants són el blau de timol, l’ataronjat de metil, el verd de bromocresol, la fenolftaleïna i la timolftaleïna Els indicadors mixts són mescles de dos indicadors o d’un indicador i un colorant, i fan més precisa la detecció del punt final Per a les volumetries de precipitació hom empra indicadors que donen lloc en el…
complexometria
Química
Procediment volumètric d’anàlisi quantitativa d’ions metàl·lics per valoració amb una solució patró d’una complexona
, especialment de la sal disòdica de l’àcid etilendiaminotetraacètic (EDTA), basat en la formació de complexos estables dels ions metàl·lics amb l’agent valorant, la qual formació dóna lloc en el punt d’equivalència a una variació brusca de la concentració d’aquells ions, que pot servir de base per a la detecció del punt esmentat.
El comportament de l’EDTA i de les complexones, en general és àmpliament selectiu per tal de poder determinar específicament cada metall cal procedir a la regulació del pH de la solució i a la introducció d’agents complexants auxiliars Així, els ions metàllics tetravalents i trivalents, que formen els complexos més estables, són valorats en medi fortament àcid, mentre que els divalents ho han d’ésser en medi neutre o bàsic segons l’estabilitat de llurs complexos Els agents complexants auxiliars cianur, trietanolamina, 2,3-dimercaptopropanol, etc són emprats per a formar amb els ions…
iodometria
Química
Mètode indirecte d’anàlisi volumètrica de substàncies oxidants, basat en la reacció d’aquestes amb un excés d’ió iodur i en la valoració amb solució patró de tiosulfat del iode alliberat segons la semiequació 2I- ⇋ I2 + 2e-
.
Les iodometries tenen lloc sempre en medi àcid, en presència de midó o d’α-naftoflavona com a indicadors Les fonts d’error possibles són l’oxidació del iodur per l’oxigen de l’aire i la pèrdua de iode per volatilització
iodimetria
Química
Mètode volumètric d’anàlisi de substàncies reductores mitjançant una solució valorant de iode, la qual conté un excés de iodur i forma el complex triiodur I- 3
.
La força oxidant del iode, segons la semiequació I - 3 + 2e - ⇋ 3I - , és suficient per a permetre la determinació de les substàncies reductores com sulfurs, sulfits i àcid sulfurós, ferrocianurs, etc, emprant midó o α-naftoflavona com a indicadors Per a valorar la solució de iode en medi neutre o lleugerament bàsic hom empra el triòxid d’arsènic o una solució de tiosulfat, en medi àcid
blau de metilè
Biologia
Química
Substància cristal·lina de color verd fosc, amb lluïssor metàl·lica, soluble en aigua, alcohol i altres dissolvents.
Sota l’acció d’agents reductors perd el color i el recupera davant agents oxidants o per simple exposició a l’aire És emprat com a colorant vital en microscòpia i també com a indicador d’oxidoreducció, com a part d’alguns indicadors mixts de neutralització Té una certa acció antisèptica, i és emprat especialment en infeccions urinàries, puix que en tenyir l’orina dún color blau verdós dóna alhora una indicació de la permeabilitat renal també és emprat en forma de tocs en les afeccions bucls i faríngies
anàlisi conductomètrica
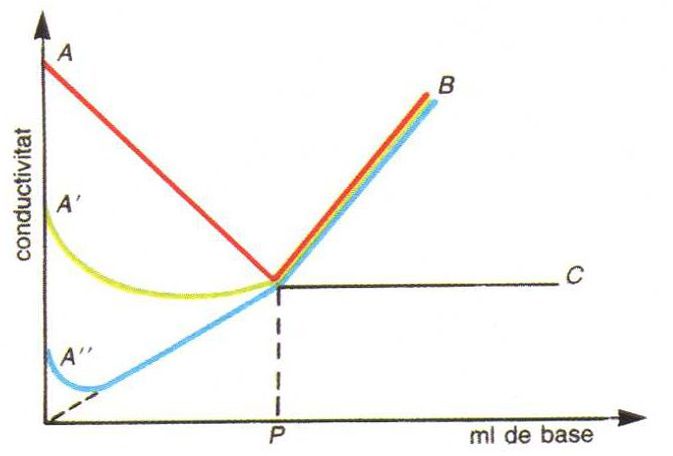
Valoració conductomètrica d’un àcid amb una base: corba AB, àcid fort amb una base forta; corba A'B, àcid mitjanament fort amb una base forta; corba A''B àcid feble amb una base feble; P, punt d’equivalència
©
Química
Procediment analític usat per a determinar el punt final de les volumetries, basat en la mesura de la variació de la conductivitat electrolítica de la solució problema deguda a l’addició de reactiu valorant.
Com que la conductivitat electrolítica depèn de la mobilitat dels ions presents en la solució i de llurs concentracions, l’addició d’un reactiu en provoca canvis importants sempre que doni lloc a la desaparició d’una espècie iònica de la solució sigui per formació d’un compost poc dissociat o d’una sal insoluble i a la seva substitució per quantitats equivalents d’un dels ions del reactiu de mobilitat diferent de la de l’espècie eliminada Així, hom pot dur a terme conductimètricament volumetries de neutralització, de precipitació i de formació de complexos, però només en casos favorables…
àcid
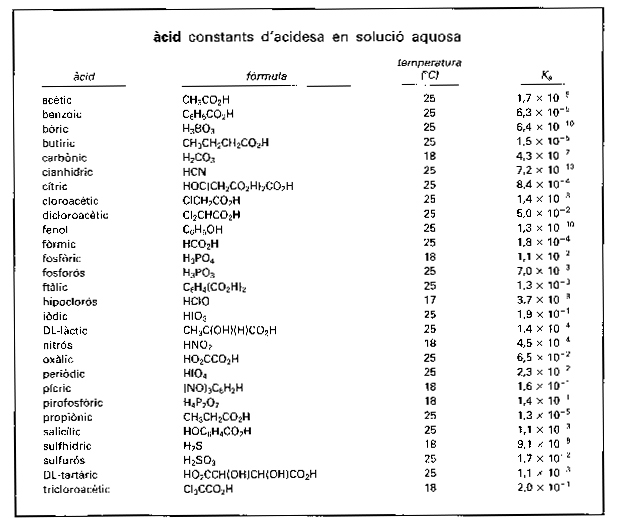
Constants d’acidesa en solució aquosa
Química
Cada una de les substàncies caracteritzades químicament pel fet de provocar canvis de color en les substàncies anomenades indicadors i de reaccionar molt ràpidament amb les substàncies d’un altre grup anomenades bases.
Les propietats típiques d’ambdós reactius desapareixen pel fet de la reacció, cosa que és interpretada com una neutralització mútua dels àcids i de les bases que dóna composts neutres tals com, per exemple, les sals Aquestes dues propietats essencials van acompanyades, en general, d’altres de menys fonamentals i no sempre presents, com el sabor àcid, l’activitat catalítica i la propietat —en solució aquosa— de dissoldre certes substàncies insolubles com els carbonats i molts metalls A més, els àcids i les bases poden desplaçar-se mútuament de llurs composts correlativament a llurs forces El…
bromatometria
Química
Part de la volumetria que inclou els mètodes d’anàlisi en els quals el reactiu valorant és una solució de bromat de potassi.
Hom aprofita analíticament les propietats oxidants d’aquest compost potencial normal de reducció = +1,45 eV de dues maneres diferents per a valorar directament substàncies reductores o per a generar quantitats controlades de brom elemental per tal d’efectuar la bromació de substàncies orgàniques En el primer cas, hom fa la determinació volumètrica en medi àcid fort, en el qual la semireacció de reducció del bromat és la següent la qual serveix per a valorar reductors com ara arsènic III, antimoni III, estany II, coure I, ferro II, talli I, nitrit, selenit, iodur, monoclorur de iode i molts d’…
acidimetria
Química
Part de la volumetria
que comprèn els mètodes d’anàlisi de substàncies de caràcter bàsic per valoració amb una solució d’un àcid de concentració coneguda.
Els mètodes de l’acidimetria són fonamentats en reaccions de neutralització , quan és una base lliure la que hom valora amb la solució àcida, o de desplaçament , quan la substància valorada és una sal d’un àcid molt dèbil i l’agent valorant un àcid fort Hom calcula la quantitat de substància bàsica problema a partir del volum d’agent valorant àcid necessari perquè la reacció arribi a ésser completa, moment que la solució assoleix un valor específic del pH Hom posa de manifest aquest moment mitjançant l’ús d’alguns dels indicadors de neutralització , substàncies orgàniques àcides…