Resultats de la cerca
Es mostren 8 resultats
nitrosació
Química
Reacció mitjançant la qual un àtom d’hidrogen d’una molècula orgànica és substituït pel grup -NO; aquesta reacció és difícil, gairebé impossible d’efectuar directament.
El NO pot fixar-se sobre els metalls naixents produïts pels composts organomagnèsics, i donar, com a subproductes, derivats nitrosats orgànics Les substàncies més fàcils de nitrosar són els fenols, les amines secundàries i les imines Els agents de nitrosació més usuals són el peròxid de nitrogen dímer N 2 O 4 , l’àcid nitrós HNO 2 , els nitrits MNO 2 , els nitrits d’alquil i, sobretot, els d’amil C 5 H 1 1 -O-NO i les sals de nitrosil NOCl, NOBr El clorur de nitrosil NOCl dissolt en toluè absolut reacciona amb els composts organomagnèsics donant derivats nitrosats en…
nitrit
Química
Qualsevol sal o èster de l’àcid nitrós.
Els nitrits són sòlids, sovint anhidres, i es dissocien per acció de la calor formant òxid nítric, nitrat i nitrogen Hom els obté per reducció dels nitrats o per reacció dels vapors nitrosos amb sosa o una altra base alcalina o alcalinotèrria Els dos nitrits més importants són el nitrit de potassi, emprat en la indústria alimentària com a additiu, i el nitrit de sodi, que en química orgànica és emprat per a diazotar les amines El complex més conegut és el cobaltinitrit de sodi, Na 3 CONO 2 6 , reactiu del potassi, del rubidi, del cesi i del talli Afegit directament…
nitrosamina
Química
Cadascuna d’aquelles substàncies que contenen el radical =N-N=O, com a resultat de la reacció entre l’àcid nitrós i les amines secundàries.
En la indústria alimentària sovint es produeixen en reaccionar els nitrits amb les amines presents en els aliments Hom ha determinat que tenen propietats cancerígenes
permanganimetria
Química
Mètode d’anàlisi volumètrica de substàncies reductores (volumetria) que fa ús d’una solució colorant de permanganat potàssic.
La força oxidant del permanganat en medi fortament àcid, segons la semiequació MnO 4 - + 8H + + 5e ⇌Mn 2 + + 4H 2 O, E ° = 1,51 V, és suficient per a permetre la determinació de substàncies reductores tals com ferroII, oxalats, ferrocianurs, nitrits, sulfits, aigua oxigenada, etc, emprant generalment el mateix reactiu valorant coloració violada com a indicador Per a valorar la solució de permanganat potàssic en medi àcid, hom empra l’oxalat sòdic com a tipus primari Una altra reacció en la qual el permanganat actua com a oxidant és MnO 4 - + 4H + + 3e ⇌MnO 2 + 2H 2 O, E ° = 1,695…
diòxid de nitrogen
Química
Líquid que bull a 26°C i es congela a —11°C.
Hom l’obté per combinació de l’oxigen amb òxid nítric, segons la reacció NO + 1/2O₂ →NO₂ + 13,57 kcal És anomenat també diòxid de nitrogen NO monòmer , o tetròxid de nitrogen N₂O₄ dímer L’equilibri N₂O₄ ⇌2NO₂ depèn de la temperatura i de l’estat físic Pot ésser obtingut per descomposició del nitrat de plom, segons la reacció PbNO₃₂ →PbO + 2NO₂ + O₂ És una substància tòxica i molt reactiva en presència de bases sofreix dismutació i dóna nitrits i nitrats, segons la reacció N₂O₄ + 20H₂ - →NO₂ - + NO₃ - + H₂O El diòxid de nitrogen és un agent oxidant emprat en el procés de les…
nitroalcà
Química
Cadascun dels derivats nitrats de les parafines, que tenen la fórmula bruta C n
H 2 n + 1
NO 2
.
Hom els obté a partir dels halurs primaris o secundaris per tractament amb nitrits metàllics, segons la reacció NO 2 Na + RCH 2 X →RCH 2 NO 2 + RCH 2 ONO o també per nitració directa dels alcans amb àcid nítric, a una alta temperatura Una propietat important dels nitroalcans és el caràcter àcid dels composts que posseeixen un àtom o més d’hidrogen en posició α en relació amb el NO 2 actuen com a àcids febles capaços de dissoldre's, segons l’equació L’acidificació d’aquestes sals precipita la forma àcida dels nitroalcans Les formes àcides dels nitroalcans són inestables i es…
àcid nitrós
Química
Oxiàcid del nitrogen format per l’acció d’àcids forts sobre nitrits inorgànics.
Només és notable en solucions fredes i molt diluïdes Es descompon segons la reacció 3HNO 2 →HNO 3 + 2NO + H 2 O A causa de la seva inestabilitat, és utilitzat i preparat in situ , per acidificació d’una solució aquosa d’un nitrit, segons la reacció És emprat per a la preparació de colorants azoics
aigua
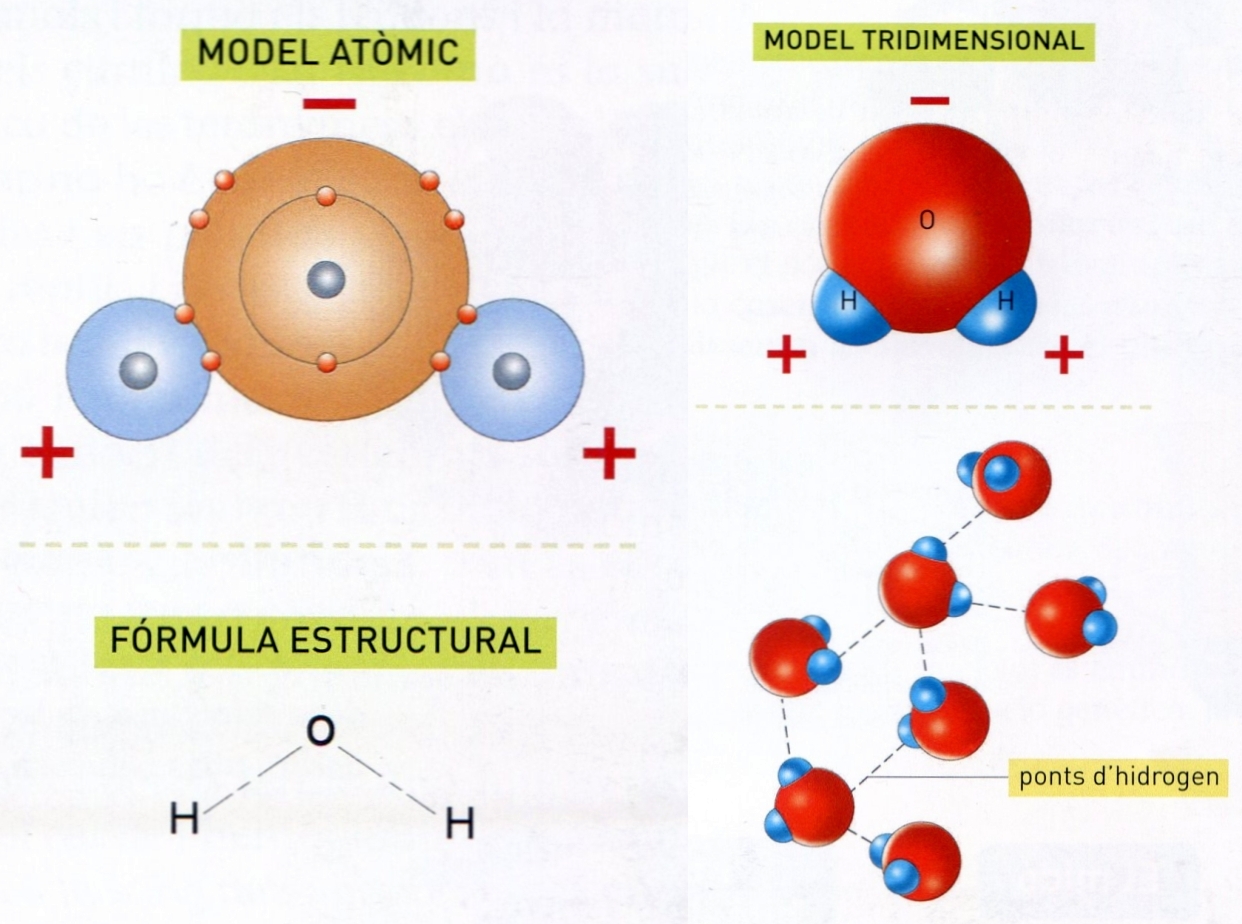
La molècula d’aigua
© Fototeca.cat
Química
Compost d’hidrogen i oxigen de fórmula H2O; atesos el seu paper a la natura i els seus innombrables usos, és la més important de totes les substàncies i fou considerada durant segles com un element.
Propietats fisicoquímiques de l’aigua Composició La seva composició fou establerta per síntesi per Cavendish el 1781 fent explotar una mescla d’hidrogen i oxigen 2H + O 2 → 2H 2 O L’anàlisi fou feta per Lavoisier i Meusnier, el 1783, descomponent el vapor amb ferro roent 4H 2 O + 3Fe → Fe 3 O 4 + 4H 2 La descomposició electrolítica H 2 O 2 + ½O 2 fou realitzada per primera vegada per Nicholson i Carlisle l’any 1800 La represa d’aquests experiments amb mètodes més precisos permeté de determinar exactament la composició ponderal, establir la fórmula definitiva i confirmar les lleis…